

熊猫宝宝
第1楼2008/08/01
酸碱指示剂 用于酸碱滴定的指示剂,称为酸碱指示剂。(acid-base indicator)。这是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。常用的酸碱指示剂主要有以下四类:
1 硝基酚类 这是一类酸性显著的指示剂,如对-硝基酚等。
2 酚酞类 有酚酞、百里酚酞和α-萘酚酞等,它们都是有机弱酸。
3 磺代酚酞类 有酚红、甲酚红、溴酚蓝、百里酚蓝等,它们都是有机弱酸。
4 偶氮化合物类 有甲基橙、中性红等,它们都是两性指示剂,既可作酸式离解,也可作碱式离解。
酸碱指示剂的发现
酸碱指示剂是检验溶液酸碱性的常用化学试剂,像科学上的许多其它发现一样,酸碱指示剂的发现是化学家善于观察、勤于思考。勇于探索的结果。
300多年前,英国年轻的科学家罗伯特·波义耳在化学实验中偶然捕捉到一种奇特的实验现象,有一天清晨,波义耳正准备到实验室去做实验,一位花木工为他送来一篮非常鲜美的紫罗兰,喜爱鲜花的波义耳随手取下一块带进了实验室,把鲜花放在实验桌上开始了实验,当地从大瓶里倾倒出盐酸时,一股刺鼻的气体从瓶口涌出,倒出的淡黄色液体世冒白雾,还有少许酸沫飞溅到鲜花上,他想“真可惜,盐酸弄到鲜花上了”,为洗掉花上的酸沫,他把花放到水里,一会儿发现紫罗兰颜色变红了,当时波义耳既新奇又兴奋,他认为,可能是盐酸使紫罗兰颜色变红色,为进一步验证这一现象,他立即返回住所,把那篮鲜花全部拿到实验室,取了当时已知的几种酸的稀溶液,把紫罗兰花瓣分别放入这些稀酸中,结果现象完全相同,紫罗兰都变为红色。由此他推断,不仅盐酸,而且其它各种酸都能使紫罗兰变为红色。他想,这太重要了,以后只要把紫罗兰花瓣放迸溶液,看它是不是变红色,就可判别这种溶液是不是酸。偶然的发现,激发了科学家的探求欲望,后来,他又弄来其它花瓣做试验,并制成花瓣的水或酒精的浸液,用它来检验是不是酸,同时用它来检验一些碱溶液,也产生了一些变色现象。
这位追求真知,永不困倦的科学家,为了获得丰富、准确的第一手资料,他还采集了药草、牵牛花,苔藓、月季花、树皮和各种植物的根……泡出了多种颜色的不同浸液,有些浸液遇酸变色,有些浸液遇碱变色,不过有趣的是,他从石蕊苔藓中提取的紫色浸液,酸能使它变红色,碱能使它变蓝色,这就是最早的石蕊试液,波义耳把它称作指示剂。为使用方便,波义耳用一些浸液把纸浸透、烘干制成纸片,使用时只要将小纸片放入被检测的溶液,纸片上就会发生颜色变化,从而显示出溶液是酸性还是碱性。今天,我们使用的石蕊、酚酞试纸、pH试纸,就是根据波义耳的发现原理研制而成的。
后来,随着科学技术的进步和发展,许多其它的指示剂也相继被另一些科学家所发现。
几种无机化学中常用的酸碱指示剂:
指示剂名称 中性色范围 酸色 中性色 碱色
甲基橙 3.1-4.4 红 橙 黄
甲基红 4.0-5.8 红 橙 黄
溴百里酚蓝 6.0-7.6 黄 绿 蓝
酚酞 8.0-10.0 无色 浅红 红
石蕊 5.0-8.0 红 紫 蓝
熊猫宝宝
第3楼2008/08/01
一、氧化还原指示剂
这类指示剂的氧化态和还原态具有不同的颜色,在滴定过程中指示剂由氧化态变为还原态,或由还原态变为氧化态。根据颜色的突变来指示终点。例如用K2Cr2O7溶液滴定Fe2+,常用二苯胺磺酸钠为指示剂,二苯胺磺酸钠的还原态为无色,氧化态为紫红色,故滴定到计量点后,过量一点K2Cr2O7就能使二苯胺磺酸钠由还原态转变为氧化态,溶液显紫红色,因而可以指示滴定终点。
如果用In(Ox)和In(Red)分别表示指示剂的氧化态和还原态,其氧化还原电对为
In(Ox) + ne = In(Red)
随着滴定过程中溶液电位值的变化,指示剂的[In(Ox)]/[In(Red)]变化
EIn = EofIn + 0.059/nlgCIn(Ox)/CIn(Red)
与酸碱指示剂的变色情况相似,当CIn(Ox)/CIn(Red)10时,溶液显氧化态的颜色,此时
EIn EofIn + 0.059/nlg10 = EofIn + 0.059/n
当CIn(Ox)/CIn(Red)1/10时,溶液呈还原态的颜色,此时
EIn EofIn + 0.059/nlg1/10 = EofIn-0.059/n
故指示剂的变色范围,EIn = EofIn ± 0.059/n(25οC)
在此范围的两侧可以看到指示剂颜色的改变,当被滴定溶液的电位值恰等于EofIn时,指示剂显中间颜色,一些常用的氧化还原指示剂列于表5-1。在实际滴定工作中,指示剂的变色范围应包括在滴定计量点前后0.1%的电位突跃范围内。例如在1.0mol·L-1H2SO4介质中,用Ce4+滴定Fe2+,前已计算出滴定计量点前后0.1%的电位突跃范围是0.86~1.26V,显然选择邻二氮菲亚铁作指示剂是合适的。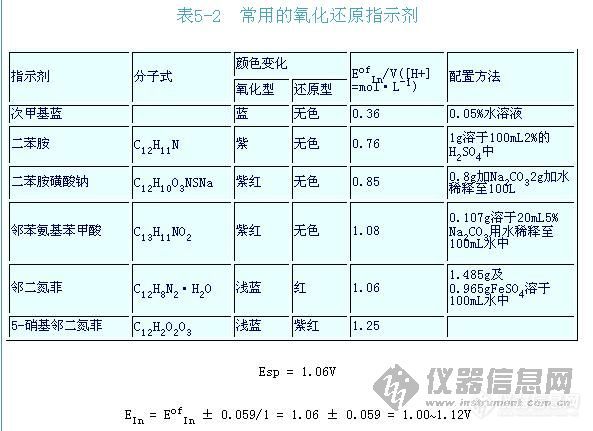
在突跃范围以内,若选用二苯胺磺酸钠为指示剂EIn=0.85±0.059/2=0.82~0.88V,与突跃范围只有很少一点重合,滴定误差必然很大,为了克服这个缺点,可在被滴定的溶液中加入一些H3PO4,它与Fe3+配位成稳定的[Fe(HPO4)]+,可以降低Fe3+/Fe2+电对的电位,使滴定突跃范围加大,计量点前按还原电对计算电位
E = EFe3+/Fe2+ + 0.059lgCFe3+/CFe2+
在计量点前99.9%的电位值为
E = EFe3+/Fe2+ + 0.059lg99.9/0.1
若使浓度降低10000倍
E=0.68+0.059lg=0.62V
即突跃范围电位变成0.62~1.26V,则二苯胺磺酸钠也是适宜的。
如前所述,氧化还原滴定反应的完全程度一般来说是比较高的,因而计量点附近的突跃范围较大,又有多种不同的指示剂可供选择,因此终点误差一般都不大,在此不作介绍。还必须指出,指示剂本身会消耗滴定剂。例如,二苯胺磺酸钠因氧化而由无色变为紫色时,需要消耗一定量的标准溶液,当标准溶液浓度比较大时,(例如0.1mol·L-1)氧化剂所消耗的标准溶液体积很小,对分析结果的影响不大。可以忽略不计,如果标准溶液的浓度很小。例如0.1mol·L-1时,就要作空白试验,测出指示剂所消耗的体积,作为空白值,然后从标准溶液的总体积中将空白值减去。
熊猫宝宝
第4楼2008/08/01
二、其它指示剂
1、自身指示剂
在氧化还原滴定中,有些标准溶液或被到底功能的物质本身有颜色,如果反应后颜色变化明显,那么断定时就不必加指示剂。例如,高锰酸钾法中,MnO4-本身显紫红色,用它滴定无色或浅色的还原剂溶液时,就不必另加指示剂,因为在滴定中被还原为Mn2+,而Mn2+几乎是无色的,所以当滴定到计量点后,只要MnO4-稍微过量就可使溶液显粉红色,表示已经达到了滴定终点。实验证明,MnO4-浓度为2*10-6mol·L-1时,就能观察到粉红色。
2、特殊指示剂
有些物质本身并不具有氧化还原性,但它能与氧化剂或还原剂产生特殊的颜色,因而可以指示滴定终点。例如,可溶性淀粉与碘溶液反应,生成深兰色的化合物,当I2被还原为I-时,深兰色消失。因此在碘量法中,可用淀粉溶液作为指示剂。又如以Fe3+滴定Sn2+时,可用KSCN为指示剂,当溶液出现红色(铁Ⅲ)的硫氢酸配合物颜色,即为终点。