

〓疯子哥〓
第1楼2009/05/07
实验材料
试剂:
1. 一步法荧光定量RT-PCR探针 (例如, Taqman®) 试剂盒;
Invitrogen SuperScript™III Platinum® 一步法定量试剂盒 (cat# 11732-020
或11745-100).
2. 分子级无菌蒸馏水 (无RNA酶和DNA酶);
3. 正反向引物 (40μM);
4. 双重标记探针(10μM);
5. 阳性对照。
供给:
1. 实验室标记笔;
2. 微量离心管格栅,96孔0.2mlPCR反应管;
3. 20μl 和 200μl 可调节移液器及滤芯枪头;
4. 0.2ml PCR 反应管盘;
5. 光学反应盖板;
6. 无菌,无核酸酶的1.5 ml微量离心管;
7. 一次性无粉手套。
仪器设备:
1. 微量离心机;
2. 漩涡振荡器;
3. 实时荧光定量PCR检测系统,含96孔的热循环反应板。
〓疯子哥〓
第2楼2009/05/07
操作程序
准备工作:
1. 避免样品污染
由于fluorogenic 5’核酸酶测定的敏感性,应特别注意假阳性产生。
推荐以下预防污染的方法:
(a) 实验准备与核酸提取使用独立区域;
(b) 实验准备与核酸提取使用专用设备(如移液器,微量离心机)和耗材(如微
量离心管,吸头);
(c) 实验开始后穿清洁工作服,并使用新的一次性无粉手套;
(d) 不同样本操作之间,以及怀疑可能污染的情况下均更换手套;
(e) 试剂和反应管的盖子应尽量关闭。
2. 仪器准备
工作台、移液管、离心机必须清洁,用去污剂净化,例如5%的漂白剂、“DNAzapTM”
或者“RNase AWAY®”来减小核酸交叉污染的风险。
3.试剂准备
注意:在试验过程中,保持所有的试剂在冰架上保持低温。
(a) 引物和探针
分装好的冰冻的引物和探针进行融化(已融的探针避光2-8℃可保存多达3个月,不
要对探针反复冻融);
涡旋振荡引物和探针;
瞬时离心引物和探针,之后置于冰架上。
(b) Real time RT-PCR的试剂
将Master Mix和酶置于冰架上;
融化2×的Reaction Mix;
颠倒混合2×的Reaction Mix;
瞬时离心2×的Reaction Mix和酶,置于冰架上。
对RT-PCR的每一步过程均进行检测
1.每个样品的RNA提取物通过分别的引物和探针进行检测:InfA, swFluA,
Swine H1 (swH1) 和RNaseP (RP)。RNaseP引物和探针是以人的RNaseP基因为
靶基因的,因此对于人的核酸可以作为内部阳性对照。
2.对于每一个过程中包括的所有引物和探针,均设立无模板对照(NTC)和
阳性模板对照(PTC)。
3.人类样本对照(HSC)提供了次级阴性对照,以便确认核酸提取过程和试
剂的完整性。
〓疯子哥〓
第3楼2009/05/07
建立反应
反应检测混合物充分混合后加入到96孔板中。然后在适当的实验反应和对照
中,加入水和提取的核酸或者阳性模板对照(PTC)。
1.为每一个引物和探针标记一个1.5ml的微量离心管;
2.对每一个建立的反应确定反应数(N)。考虑到NTC、PTC、HSC反应和
吸量误差,制备过量的反应混合物是必要的。具体如下:
如果包括对照,样品的数量(n)为1到14,那么N=n+1;
如果包括对照,样品的数量(n)大于15,那么N=n+2。
3.Master Mix:计算加到每个引物/探针反应混合物中的各个试剂的量。计
算如下: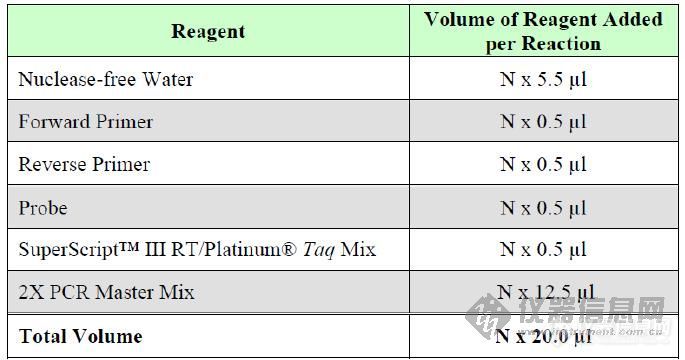
加入水之后,通过上下吹打混匀反应混合物,不要涡旋振荡。
5.离心5s使混合物聚集管底,然后将管子置于冰架上;
6.准备板状的反应管子或者96孔板,置于冰架上;
7.每一个master mix吸取20μl到每一孔中,每排按顺序进行,如下图:
实验建立举例: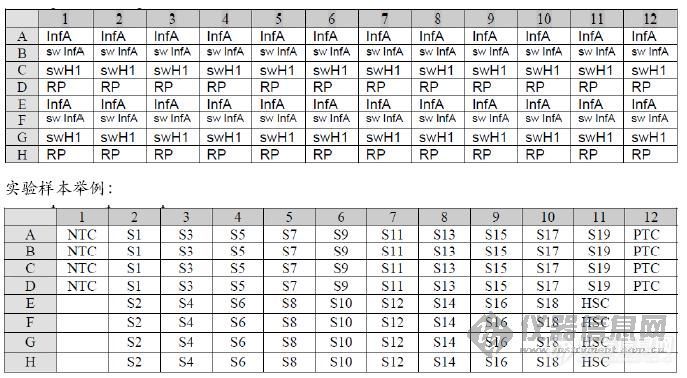
注意:在任何样本被加入之前,应该首先加入阴性模板对照(NTC)(第1列),
用来检验master mix中的污染。HSC应该在待测样本之后加入(第11列),用来
检验在样本准备或者加入过程中的交叉污染。阳性模板对照(PTC)应该在所有
样品和阴性模板对照(NTC)之后被加入。
8.在将培养板移到核酸处理区域之前,在试验设定区域,在反应板的第一列将
NTC反应进行。如上所述。
9.吸取5μl的nuclease free water到NTC孔,将NTC孔盖上。
10.将反应板盖上,移到核酸处理区域。
11.将含有样品的管子涡旋振荡5s,瞬时离心5s;
12.将提取的核酸样本置于冰架上;
13.如上所述,样品应该按列加入,吸取5μl的第一种样本到所有标记这种样品
的孔中(例如,样本“S1”如上表格所示)。不同样本之间需更换枪头操作。
14.加完样本的孔要盖住,这将会帮助防止样品的交叉污染,并且能够使操作人
员记录其加样的具体进程;
15.为了避免交叉污染,必要时更换手套;
16.对剩下的样本,重复步骤13-15;
17.加入5μl的HSC样品加到HSC孔中(第11列)。将HSC孔盖盖。
18.最后,加5μl阳性模板对照RNA到所有PTC孔中,将PTC孔盖上。
19.如果使用8个管子的条状板子,每一条都要做标签标记,来指明每一个样品
的位置(不要在反应管子的顶部标记!)。瞬时离心条状管子10-15s,然后置于
冰架上。
如果使用培养板,4℃,500g离心30s,置于冰架上。
〓疯子哥〓
第4楼2009/05/07

解释说明/检验
1. 探针/引物的阴性对照反应中得到的荧光增长曲线不应该超过阈值线。如果一
个或者多个引物和探针的阴性反应出现了假阳性,则样品可能已经被污染。
那么整个实验过程是无效的,严格的按照步骤规则重新实验。
2. 在37 个循环处或者37 个循环之前,所有的临床样本的RP 反应曲线都应该
超过阈值线,这表明从人类RNase P 基因扩增到足够量的RNA,也表明了样
本质量合格。然而,可能有些样本会由于初始临床样本中的细胞数量较少而
无法出现阳性结果。同时,从动物/禽类体内或者经细胞培养得到的样本,经
常会RP 反应没有结果或者结果很弱。如果在所有临床样本中检测RNase P
都阴性,则说明:
(a)从临床材料中对核酸的不适当的提取导致RNA 的损失或者来自临床标
本的RT-PCR 抑制剂的残留污染;
(b)没有足够的人类细胞以备检测;
(c)方法建立和实施不当;
(d)试剂和仪器原因。
3. 在40 个循环之内,HSC 组中InfA,swFluA,swH1 探针的荧光增长曲线不
应该超过阈值线。如果任何其中任何一个流感特异性探针的增长曲线超过了
阈值线,那么有以下解释:
(a)可能由于RNA提取试剂污染。在实验前确保RNA提取试剂无误。
(b)RNA提取过程或建立反应加样过程发生交叉污染。严格遵照操作程序
的要求进行重复实验。
4. 在40 个循环之前,PTC 反应的InfA, swInfA, swH1 和RP 反应应出现阳性
结果。如果没产生预期的阳性结果则视为无效,应严格遵照操作程序进行重
复实验。确定PTC 反应失败原因,订正并记录错误原因及更改方案。不再使用没产生预期结果的PTC 试剂。
5. 当所有对照都满足要求后,如果InfA反应增长曲线与阀值线在40个循环内有
交叉时,则样本被视为A型流感病毒阳性。如果A型流感病毒反应呈阳性,那
么Univ SW 和/或 SW H1也可能呈阳性。如果样本InfA和特异亚型反应
(swInfA和swH1)的反正增长曲线与阈值线在40个循环内有交叉,则视该样
本为猪流感病毒A/H1阳性。如果样本只有InfA和一个亚型的反应阳性或只有
InfA阳性,请联系CDC做进一步指导。
6. 在所有对照都满足要求的前提下,如果在40个循环内,待测样本的所有InfA
反应阴性则视该样本为阴性。
限制规定
1. 实验员在实际操作之前应进行操作程序和试验结果分析的培训,熟练掌握后
方可进行试验。
2. 当样本量不足可能会产生假阴性结果,造成的原因可能是不当的收集,运输
或处理。
3. 如果反应中存在过量的DNA / RNA 模板时也可能出现假阴性。如果某样本
的RP 反应被抑制,则可以将提取的RNA 进行2 倍或更大倍数的稀释(例如
1:10 或1:100)来重复试验。