

工农兵
第1楼2009/10/14
(二)盐类水解的类型
类型 酸碱性 PH 举例
强酸弱碱盐水解 溶液显酸性 pH<7 NH4Cl、AlCl3、FeCl3、CuSO4等
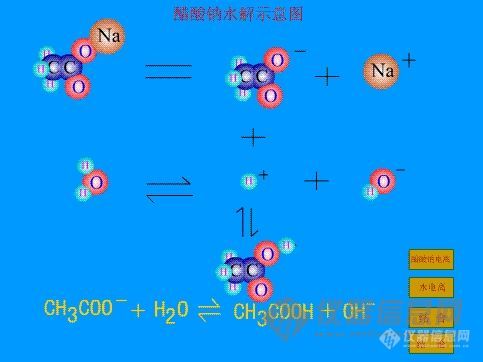
强碱弱酸盐水解 溶液显碱性 pH>7 CH3COONa、Na2CO3、Na2S等
强酸强碱盐不水解 溶液显中性 pH=7 KCl、NaCl、Na2SO4等
弱酸弱碱盐水解 水解后溶液的酸碱性由对
应的弱酸弱碱的相对强弱决定 —— CH3COONH4等
(三)相关内容
1.定义:在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解。
2.实质:弱电解质的生成,破坏了水的电离,促进水的电离平衡的过程。
3.规律:有弱才水解、都弱都水解、越弱越水解、谁强显谁性。
(即盐的构成中出现弱碱阳离子或弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,水解程度越大,溶液的pH变化越大;水解后溶液的酸碱性由构成该盐离子对应的酸和碱相对强弱决定,酸强显酸性,碱强显碱性。)
4.特点:
(1)水解反应和中和反应处于动态平衡,水解进行程度很小。
(2)水解反应为吸热反应。
(3)盐类溶解于水,以电离为主,水解为辅。
(4)多元弱酸根离子分步水解,以第一步为主。
5.盐类水解的离子反应方程式
因为盐类的水解是微弱且可逆的,在书写其水解离子反应方程式时应注意以下几点:
(1)应用可逆符号表示,
(2)一般生成物中不出现沉淀和气体,因此在书写水解离子方程式时不标“↓”“↑”
(3)多元弱酸根的水解分步进行且步步难,以第一步水解为主。
工农兵
第2楼2009/10/14
6.水解平衡的因素
影响水解平衡进行程度最主要因素是盐本身的性质。外界条件对平衡移动也有影响,移动方向应符合勒夏特列原理,下面以NH4+水解为例:
①.温度:水解反应为吸热反应,升温平衡右移。
②.浓度:改变平衡体系中每一种物质的浓度,都可使平衡移动。盐的浓度越小,水解程度越大。
③.溶液的酸碱度:加入酸或碱能促进或抑制盐类的水解。例如:水解呈酸性的盐溶液,若加入碱,就会中和溶液中的H+,使平衡向水解的方向移动而促进水解;若加入酸,则抑制水解。
同种水解相互抑制,不同水解相互促进。(酸式水解——水解生成H+;碱式水解——水解生成OH-)
三.盐类的水解实例
(一).以NH4+ + H2O、NH3·H2O + H+ 为例:
条件 c(NH4+) c(NH3·H2O) c(H+) c(OH-) pH 水解程度 平衡移动方向
加热 减少 增大 增大 减少 减少 增大 正向
加水 减少 减少 减少 增大 增大 增大 正向
通入氨气 增大 增大 减少 增大 增大 减少 逆向
加入少量
NH4Cl固体 增大 增大 增大 减少 减少 减少 正向
通入氯化氢 增大 减少 增大 减少 减少 减少 逆向
加入少量
NaOH固体 减少 增大 减少 增大 增大 增大 正向
工农兵
第4楼2009/10/14
四、水解过程中的守恒问题(以Na2HCO3水解为例,HCO3-既水解又电离)
Na2HCO3溶液中存在Na+,H+,OH-,HCO3-,CO32-,H2CO3
①.电荷守恒——溶液中所有阳离子带的正电荷等于所有阴离子带的负电荷
c(Na+)+c(H+)===c(OH-)+2c(CO32-)+c(HCO3-)
②.物料守恒(原子守恒)——溶液中某些离子能水解或电离,这些粒子中某些原子总数不变,某些原子数目之比不变
n(Na):n(C)==1:1 所以 c(Na+)===c(HCO3-)+c(CO32-)+c(H2CO3)
③.水的电离守恒(也可以由上述两式相减得到)
c(H+)+c(H2CO3)===c(OH-)+c(CO32-)
五、双水解反应
双水解反应——一种盐的阳离子水解显酸性,一种盐的阴离子水解显碱性,当两种盐溶液混合时,由于H+和OH-结合生成水而相互促进水解,使水解程度变大甚至完全进行的反应。
①.完全双水解反应
离子方程式用==表示,标明↑↓,离子间不能大量共存
种类:Al3+与CO32- HCO3- S2-,HS-,亚硫酸氢根,偏铝酸根
Fe3+与CO32- HCO3-
2Al3++3S2-+6H2O===Al(OH)3↓+3H2S↑
②.不完全双水解反应
离子方程式用可逆符号,不标明↑↓,离子间可以大量共存
种类:NH4+与CO32- HCO3- S2-,HS-,CH3COO-等弱酸根阴离子
③.并非水解能够相互促进的盐都能发生双水解反应
工农兵
第5楼2009/10/14
有的是发生复分解反应——Na2S+CuSO4===NaSO4+CuS↓
有的是发生氧化还原反应——2FeCl3+Na2S===2FeCl2+S↓+2NaCl或2FeCl3+3Na2S===2FeS↓+S↓+6NaCl
PS:离子间不能大量共存的条件——生成沉淀、气体、水、微溶物、弱电解质;发生氧化还原、完全双水解反应
(多元弱酸的酸式酸根离子不能与H+或OH-离子共存;在酸性条件下,NO3-和MnO4-具有强氧化性)
六、盐溶液蒸干后
①.盐水解生成挥发性酸,蒸干后得到其氢氧化物,如FeCl3蒸干后得到Fe(OH)3
盐水解生成难挥发性酸或强碱,蒸干后得到原溶质,如Na2SO4
②.阴阳离子均易水解的盐,蒸干后得不到任何物质,如(NH4)2S
③.易被氧化的物质,蒸干后得到其氧化产物,如Na2SO3溶液蒸干后得到Na2SO4
④.受热易分解的物质,蒸干后得到其分解产物,如Mg(HCO3)2蒸干后得到Mg(OH)2
工农兵
第6楼2009/10/14
七、盐类水解的应用
①.配制FeCl3溶液——将FeCl3先溶于盐酸,再加水稀释
②.制备Fe(OH)3胶体——向沸水中滴加FeCl3溶液,并加热至沸腾以促进Fe3+水解
Fe3++3H2O=加热=Fe(OH)3(胶体)+3H+
③.泡沫灭火器——Al3++3HCO3-===Al(OH)3↓+3CO2↑
④.纯碱作洗涤剂——加热促进其水解,碱性增加,去污能力增强
八、盐类水解内容补充
①.电离大于水解(溶液呈酸性)的离子——亚硫酸氢根,磷酸二氢根,草酸氢根HC2O4-
其余多元弱酸的酸式酸根离子均是水解大于电离(溶液呈碱性)
②.pH 酸<酸式水解的盐 碱>碱式水解的盐
③.酸根离子相应的酸越弱,其强碱弱酸盐的碱性越强
如酸性 Al(OH)3
【盐类的水解的例题】
例1.下列离子反应方程式中,不属于水解反应的是
A.NH4++H2ONH3·H2O+H+
B.NH3·H2O NH4++OH-
C.HCO3-+H2OH3O++CO32-
D.AlO2-+2H2OAl(OH)3+OH-
分析与解答:
B、C选项是电离方程式,水解反应后一定有弱酸或弱碱。
答案:B、C
例2.若室温时,0.1mol/L的盐NaX溶液的pH=9。则该溶液中起水解的X—占全部的X—的
A.0.01% B.0.09% C.1.0% D.无法确定
分析与解答:
NaX的水解反应为:X- + H2OHX+OH-,起水解反应c(X-)=c(OH—)=1×10-5mol/L,水解率为=0.01%
答案:A
工农兵
第7楼2009/10/14
例3.25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是( )
①KNO3 ②NaOH ③CH3COO NH4 ④NH4Cl
A.①>②>③>④ B.④>③>①>②
C.③>④>②>① D.③>④>①>②
分析与解答:
①KNO3为强酸强碱盐,在水溶液中电离出的K和NO对水的电离平衡无影响②NaOH为强碱在水溶液中电离出的OH对水的电离起抑制作用,使水的电离程度减小③CH3COONH4为弱酸弱碱盐,在水溶液中电离出的NH和CH3COO均可以发生水解生成弱电解质NH3·H2O和CH3COOH,并能相互促进,使水解程度加大从而使水的电离程度加大。④NH4Cl为强酸弱碱盐,在水溶液中电离出的NH可以发生水解生成弱电解质NH3·H2O,促进水的电离,但在相同浓度下其水解程度要小于CH3COONH4,该溶液中水的电离程度小于CH3COONH4中的水的电离程度。
答案D
小结:酸、碱对水的电离起抑制作用,盐类的水解对水的电离起促进作用。
例4.SOCl2为一种易挥发的液体,当其与水相遇时剧烈反应,生成一种能使品红褪色的气体写出该反应的化学反应方程式。
分析与解答:
SOCl2中S为+4价,O为-2价,Cl为-1价,当其与水相遇时所生成的使品红褪色的气体应是SO2,本反应不是氧化——还原反应。故其反应方程式为SOCl2+H2O=SO2+2HCl,本题虽属于水解反应,但有别于盐类的水解,而且根据题目所述剧烈反应,可以判断该反应进行的彻底故用“=”表示之。
工农兵
第8楼2009/10/14
【参考练习】
1.常温下,0.1mol/L的下列溶液中,水的电离程度大小排列顺序正确的是
①AlCl3 ②KNO3 ③NaOH ④NH3·H2O
A.①>②>③>④ B.①>②>④>③
C.③>④>②>① D.①=②=③=④
2.已知0.1mol/LNaHCO3溶液的pH为8.4,0.1mol/LNa2CO3溶液的pH为11.4,则NaHCO3溶液中由H2O电离出c(OH-)是Na2CO3溶液中由H2O电离出的c(OH-)的
A.3倍 B.1/3倍
C.103倍 D.10-3倍
3.物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3中c(CO32-)由小到大的排列顺序为
A.⑤④③②① B.③⑤②④①
C.③②⑤④① D.③⑤④②①
4.相同物质的量浓度的下列铵盐中c(NH4+)最大的是
A.NH4HCO3 B.NH4HSO4
C.NH4NO3 D.CH3COONH4
工农兵
第9楼2009/10/14
5.pH=3的二元弱酸H2R溶液与VL pH=11的NaOH溶液混合后,混合液的pH=7。下列判断正确的是
A.溶液的总体积为2VL
B.溶液中c(R2-)>c(Na+)>c(H+)=c(OH-)
C.溶液中c(R2-)+c(OH-)=c(Na+)+c(H+)
D.溶液中2c(R2-)+c(HR-)=c(Na+)
6.下列各组数据中,其比值为2:1的是( )
A.常温下PH=7的氨水与硫酸铵的混合液中c(NH)与c(SO)之比
B.同温下0.2mol/L HCOOH溶液与0.1mol/L HCOOH溶液中c(H+)之比
C.Na2S溶液中,c(Na+)与c(S2-)之比
D.PH=12的KOH溶液与PH=12的Ba(OH) 2溶液中溶质的物质的量浓度之比
7.下列微粒中,不能促进水电离的是( )
A.所有离子中半径最小的离子
B.含有的电子数和质子数均与Na+相同,共含有5个原子核的微粒
C.还原性最弱的非金属阴离子
D.含有2个原子核,10个电子的阴离子
8.下列溶液加入金属镁可以产生H2的是( )
A.CH3COOH B. NaHCO3
C.NH4Cl D. NaClO
9.能证明醋酸是一种弱电解质的实验是( )
A.醋和水以任意比例溶解
B.中和10ml 0.1mol/L的CH3COOH须用0.1mol/L 10mlNaOH溶液
C.1mol/L CH3COONa溶液的pH大约是9
D.1mol/L CH3COOH溶液能使石蕊试液变红
参考答案:
1B
2D
3B
4B
5D
6AD
7AD
8AC
9 C