

第1楼2005/11/18
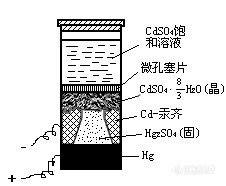
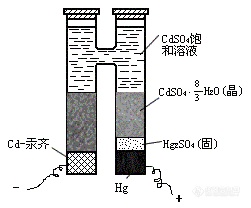
图1 饱和式标准电池构造示意图
电池放电反应如下:
负极反应: Cd(汞齐) → Cd2+ + 2e-
Cd2++SO + H2O → CdSO4∙ H2O(s)
正极反应: Hg2SO4(s)+2e- → 2Hg(l) + SO
电池反应:Cd(汞齐) + Hg2SO4(s) + H2O → 2Hg(l) + CdSO4∙ H2O
标准电池制作时只有严格按规定的配方与工艺进行,才能保证所得的电动势值都基本一致,且在恒温下可长时间保持不变,即其电动势有很好的重现性和稳定性。因此,它是电化学实验中基本的校验仪器之一。
标准电池检定后只给出20℃下的电动势值,为Es(20℃)=1.018646V。在实际测量时,若温度为t℃,则其电动势Es按下式计算:
Es/V= 1.018646 - 4.06×10-5(t/℃ - 20) - 9.5×10-7(t/℃ - 20)2
尽管标准电池的可逆性很好,但仍应严格限制通过标准电池的电流。标准电池使用时应注意以下几点:
(1)精密标准电池应在恒温下使用,使用温度范围最好为4~40℃。温度变化大将会使电动势长时间才能达到平衡,因此温度波动应尽可能小;
(2)正负极不能接错;
(3)机械振动会损坏标准电池,因此携取要平稳,水平放置,绝不能倒置或过分倾斜、摇动。标准电池手摇动后其电动势会改变,应静止5 h以上再用;
(4)标准电池只是校验器,不能作为电源使用,不允许用万用表、伏特表直接测它的电压;测量时间必须短暂、间歇地按键;一般要求通过的电流应小于1μA。若电池短路,电流过大,则损坏电池;
(5)电池若未加套盖而直接暴露于日光下,会使硫酸亚汞变质,电动势下降;
(6)按规定时间对标准电池进行计量校正。
此外,还有一种标准电池是干式的,其中溶液呈糊状且不饱和,故也称不饱和标准电池。这种标准电池的精度略差,一般可免除温度校正,常安装在便携式的电位差计之中。
第2楼2005/11/18
12、参比电极
(1)甘汞电极
实验室中最常用的参比电极是甘汞电极。作为商品出售的有单液接与双液接的两种,前
者的结构如图2所示。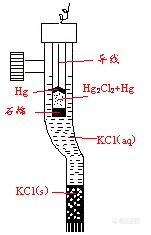
图2 甘汞电极
甘汞电极的电极反应为:
Hg2Cl2 (s) + 2e- → 2Hg (l) + 2Cl-(a )
它的电极电位可表示为:
E甘汞 = E{Cl-| Hg2Cl2(s),Hg} = E{Cl-| Hg2Cl2(s),Hg}- ln a
E{Cl-| Hg2Cl2(s),Hg}为甘汞电极的标准电极电位,aCl‾为溶液中Cl-离子的活度。
由上式知,E甘汞值仅与温度T和aCl‾有关。甘汞电极中常用的KCl溶液有0.1 mol∙L–1、1.0 mol∙L–1和饱和等三种浓度,其中以饱和式最常用(使用时溶液内应保留少许KCl晶体,以保证饱和)。各种浓度的甘汞电极的电极电位与温度的关系见表1。
表1不同KCl溶液浓度的E甘汞与温度的关系
KCl溶液浓度/mol•dm-3 电极电位E甘汞/V
饱和
1.0
0.1 0.2412–6.61×10-4(t/℃–25)
0.2801–2.75×10-4(t/℃–25)
0.3337–8.75×10-5(t/℃–25)
各文献上给出的甘汞电极的电位数据常常不相符合,这是因为接界电势的变化对甘汞电极电位有影响,由于所用盐桥的介质不同也影响甘汞电极电位的数据。
使用甘汞电极时须注意:
① 因甘汞电极在高温时不稳定,故它一般适用于70℃以下的测量;
② 甘汞电极不宜用在强酸或强碱性介质中,因此时的液体接界电位较大,且甘汞电极可能被氧化;
③ 若被测溶液中不允许含有氯离子,则应避免直接插入甘汞电极,这时应使用双液接甘汞电极;
④ 保持甘汞电极的清洁,不得使灰尘或局外离子进入该电极内部;
⑤ 当电极内部溶液太少时应及时补充。
饱和甘汞电极在实验中的制备方法:取玻璃电极管,在其底部焊接一铂丝。取化学纯汞约1 mL,加入洗净并干燥的电极管中,铂丝应全部浸没。在一个干净的研钵中放一定量的甘汞(Hg2Cl2)、数滴纯净汞与少量饱和KCl溶液,仔细研磨后得到白色的糊状物(在研磨过程中,如果发现汞粒消失,应再加一点汞;如果汞粒不消失,则再加一些甘汞……以保证汞与甘汞相互饱和)。随后,在此糊状物中加入饱和KCl溶液,搅拌均匀成悬浊液。将此悬浊液小心地倾入电极容器中,待糊状物沉淀在汞面上后,注入饱和KCl溶液,并静止一昼夜以上,即可使用。
第3楼2005/11/18
(2)银-氯化银电极
银-氯化银电极与甘汞电极相似,都是属于金属-微溶盐-负离子型的电极。它的电极反应
和电极电位表示如下:
AgCl(s) + e- → Ag(s) + Cl–(a )
E{Cl– | AgCl , Ag}=E{Cl– | AgCl , Ag}– ln a
可见,E{Cl– | AgCl , Ag}也只决定于温度与氯离子活度a 。
制备银-氯化银电极方法很多。较简便的方法是:取一根洁净的银丝与一根铂丝,插入1.0 mol∙L–1的盐酸溶液中,外接直流电源和可调电阻进行电镀。控制电流密度为5 mA∙cm-2,通电时间约5min,在作为阳极的银丝表面即镀上一层AgCl。用去离子水洗净,为防止AgCl层因干燥而剥落,可将其浸在适当浓度的KCl溶液中,保存待用。
银-氯化银电极的电极电位在高温下较甘汞电极稳定。但AgCl(s)是光敏性物质,见光易分解,故应避免强光照射。当银的黑色微粒析出时,氯化银将略呈紫黑色。
13、盐桥
盐桥的作用在于减小原电池的液体接界电位。
常用盐桥(质量分数为3%琼脂-饱和KCl盐桥)的制备方法如下:将盛有3 g 琼脂和97 mL蒸馏水的烧瓶放在水浴上加热(切忌直接加热),直到完全溶解。然后,加30 g KCl,充分搅拌。KCl完全溶解后,立即用滴管或虹吸管将此溶液装入已制作好的U形玻璃管(注意,U形管中不可夹有气泡)中,静止,待琼脂冷却凝成冻胶后,制备即完成。多余的琼脂-KCl用磨口瓶塞盖好,用时可重新在水浴上加热。将此盐桥浸于饱和KCl溶液中,保存待用。
所用KCl和琼脂的质量要好,以避免玷污溶液。应选择凝固时呈洁白色的琼脂。
高浓度的酸、氨都会与琼脂作用,从而破坏盐桥,污染溶液。若遇到这种情况,不能采用琼脂盐桥。
盐桥内除用KCl外,也可用其他正负离子的迁移数相接近的盐类,如KNO3、NH4NO3等。具体选择时应防止盐桥中离子与原电池溶液中的物质发生反应,如原电池溶液中含有能与Cl-作用而产生沉淀的Ag+、Hg 离子或含有能与K+离子作用的ClO 离子,则不可使用KCl盐桥,应选用KNO3或NH4NO3盐桥。
第4楼2005/11/18
二、电池电动势
对于所设计的电池,连接右端电极(正极)的金属引线与连接左端电极(负极)的相同金属引线之间的内电势差称为电池电势。通过原电池的电流为零(电池反应达到平衡)时其电池电势称为电池电动势,其符号用E表示,单位为伏特。由于电动势的存在,当外接负载时,原电池就可对外输出电功。
须指出,实用电池都是不可逆电池,因它不满足通过电极的电流为无限小的条件。然而,研究可逆电池的意义在于指导实践,其结果能揭示一个原电池将化学能转化为电能的极限,利用其电动势随温度和压力的变化可进一步求得电池反应的热力学状态函数的变化,这就能为在此基础上改进电池性能提供理论依据。
目前,单电极电势之绝对值还不能从实验测定或从理论计算得到。通常所指的电极电势均系相对于标准电极而言。标准电极除了使用标准氢电极外,也可以使用其他电极作为次标准电极,或称参比电极,常用的参比电极有甘汞电极和银-氯化银电极。
三、电池电动势测定的应用
可逆电池电动势的测定有多方面的应用,主要有:
1、 获得化学反应的热力学函数变化值( rH、 rS、 rG);
2、 获得化学反应的平衡常数;
3、 获得电池的标准电动势及标准电极电势;
4、 获得电解质溶液的离子平均活度系数;
5、 获得难溶盐的活度积和弱酸的解离平衡常数;
6、 获得溶液的pH值;
7、 获得溶液中离子的迁移数;
8、 用电动势测定方法研究化学反应动力学,获得反应速率常数。
本实验要求学生:
1、理解可逆电极、可逆电池和可逆电池电动势等基本概念。
2、掌握用对消法测定电池电动势的原理及盐桥、参比电极和电位差计的使用方法;
3、通过测定设计电池的电动势,获得硫酸铜溶液离子的平均活度系数与其浓度之间的关系,进而加深对电解质溶液非理想性的认识。
4、了解电动势测定方法在科学研究和生产实践中的一些重要应用。
参考文献
1、洪惠婵,黄钟奇. 物理化学实验. 广州:中山大学出版社, 1993,143-149
2、刘冠昆,车冠全,陈六平,童叶翔编著. 物理化学. 广州:中山大学出版社,2000
3、复旦大学等. 物理化学实验(第二版). 北京:高等教育出版社,1993
4、北京大学化学系物理化学教研室. 物理化学实验(第三版). 北京:北京大学出版社,1995
5、陈大勇,高永煜编. 物理化学实验. 上海:华东理工大学出版社,2000
6、夏海涛主编. 物理化学实验. 哈尔滨:哈尔滨工业大学出版社,2003
7、J. M. White. Physical Chemistry Laboratory Experiments. Englewood Cliffs, New Jersey:
Preetice-Hall. Inc., 1975, 451-466
8、D. P. Shoemaker, et al.Experiments in Physical Chemistry.New York: McGraw-Hill Book Company, 1989, 270-275
9、林清枝. 电动势与温度关系实验的改进. 大学化学. 1989,4(1): 48
10、李咸宿,陈希慧. 介绍改进型电动势测量装置. 广西化工. 1994, 23(3): 56-57
11、郁章玉,杨举祥. 10-40℃下ZnSO4、CuSO4溶液的活度系数的测定. 曲阜师范大学学报(自然科学版). 1994, 20(2): 58-61
12、张波. 电位差计测量电池电动势的误差分析. 沈阳大学学报. 1994, (2): 27-30
13、卓克垒,王键吉,夏志清,卢雁,卢锦梭. 电动势法在电解质溶液的热力学研究中的应用. 化学通报. 1995, (9): 21-27
14、张德生,陈一. Cu(Ⅱ)的L-Clu配合物稳定常数测定. 安庆师范学院学报(自然科学版). 1995, 1(2): 52-54
15、刘正铭,阚锦晴,周峰. 电动势法测定ZnCl2溶液的活度系数. 南京师范大学学报(自然科学版). 1995,18(4):79-82
16、曹熙芳,陈文生. 生物化学中的标准态及其影响. 湖北教育学院学报(自然科学版). 1995, (4): 49-52
17、闫卫东,姚加,谢学鹏,韩世钧. 用电动势法测定NaBr在甲醇-水体系中298.15K下的离子迁移数. 化学物理学报. 1996, 9(6): 552-558
18、姬鸿斌. ZnCl2溶液平均活度系数测定方法的改进.宁夏工学院学报(自然科学版). 1996, 8(3): 82-84
19、柳闽生. 对可逆电池电动势表达式若干问题的探讨. 九江师专学报. 1997, 15(5): 79-82
20、王郁萍,高农. 原电池电动势测量仪的研制. 哈尔滨建筑大学学报. 1999, 32(2): 125-126
21、姚加,闫卫东,谢学鹏,韩世钧. NaBr在乙醇-水体系中298.15K下的离子迁移数. 浙江大学学报(工学版). 1999, 33(1): 33-39
22、朱湘柱,胡晓岚. 测量可逆电池电动势的一种新方法. 大学物理实验. 2000, 13(3): 38-40
23、娄彝忠,许定生. 电动势的测量和计算. 大学物理实验. 2001, 14(4): 12-13
24、张德生,苏英. 电极电势与温度关系式的测量. 安庆师范学院学报(自然科学版). 2002, 8(1): 76-80
25、林彩萍,李芳,钟爱国. 电极制备及电池电动势测定实验装置的改进. 实验技术与管理. 2002, 19(6): 52
26、胡惠康,许新华,赵国华. 电动势法研究甲酸溴化反应动力学. 实验室研究与探索. 2002, 21(2): 58-59
27、王琴萍,吕殿祯,张莉,孙雪丽,杨家振. 乙二醇和水混合溶剂多组分电解质热力学. 物理化学学报. 2003, 19(2): 115-119
28、张德生,颜莉莉. 电动势法测量离子平均活度系数和标准电极电位. 安庆师范学院学报(自然科学版). 2003, 9(3): 33-35
29、王琴萍,吕兴梅,陈洪涛,周丽华,陈树森,吕殿祯. 盐酸在硫酸镍水溶液中的活度系数. 物理化学学报. 2004, 20(2): 186-190
30、支启军. 用示波器测电池的电动势和内电阻. 大学物理实验. 2004, 17(1): 47-49
第5楼2005/11/18
实验原理
当电池处于平衡时,两个电极间的电势差即为该电池的电动势。例如:
PtHg(l)Hg2Cl2(s) KCl(饱和)‖CuSO4(aq)Cu
这是铜电极与饱和甘汞电极组成的电池,其电动势为:
-
= + - (1)
式中: , 为活度,m为质量摩尔浓度, 为硫酸铜溶液离子的平均活度系数。
测量电池电动势最常用的方法是补偿法(也称对消法),其原理是在待测电池上并联一个大小相等、方向相反的外加电势,这样待测电池中就没有电流通过,外加电势差的大小就等于待测电池的电动势,如图3所示。B为大容量的工作电池,常用甲电池。AC为一均匀电阻,使回路中有合适的工作电流I,这样在AC上就有一均匀的电势降产生。 为标准电池。为了求得AD1线段的电势差,在测量待测电池之前,先用标准电池 来标定。将选择开关SW接 上,调节活动触点的位置至D1时检流计G中没有电流通过。此时标准电池的电动势正好与AD1线段所示的电势差的数值相等而方向相反。即
=IRAD (2)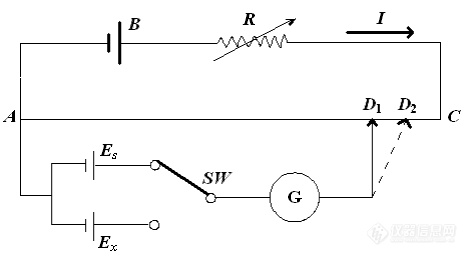
第6楼2005/11/18
图3 补偿法测定电池电动势原理线路(一)
完成上述标定后,将SW拨到待测电池 上,重新调节接触点,当调到D2位置时检流计G中无电流通过,则AD2线段上的电势降等于待测电池 的电动势,即
=IRAD (3)
由(2)式和(3)式,得:
= (4)
由于电阻与电阻线长度l成正比,所以
于是
= (5)
已知标准电池的电动势为 =1.018646 V(20℃),如在电阻线AC上标上读数,使D1点为1.018646 V,同时用可变电阻R调节电流I,使AD1段产生的电势降等于1.018646 V。此时,当检流计G指示无电流通过时,则
= =1.018646 = (6)
这样,D2的读数就是待测电池电动势的数值。实验室常用的电位差计就是根据这一原理设计制造的。
在调节平衡时,为防止过大的电流通过D1GA而损坏 及G,故在D1GA间串接一保护电阻 ,并在检流计G上并联一个开关 ,如图4所示。测量时,无论SW拨到 或 ,都要先按 ,调节触点至G基本上无电流通过时,再接 ,调节触点直到G指示无电流通过。如在按 或 后,G的光点摆动不易停下,可拨 使它迅速停下。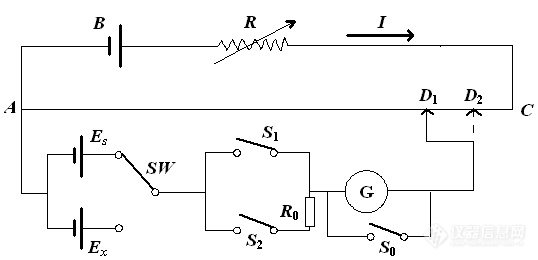
第7楼2005/11/18
试剂仪器
1、试剂
标准浓度硫酸铜溶液;镀铜溶液(CuSO4•5H2O 125 g•L-1,H2SO4 25g•L-1,乙醇50 mL •L-1);饱和KCl溶液;蒸馏水。
2、UJ24型电位差计1台;标准电池1个(结构见“背景知识”的图1);饱和甘汞电极1支;甲电池(1.5 V)2个; 光点反射式检流计1台;低压直流电源1台;滑线电阻(2000 Ω)1只;0-50 mA电流表1只;铜电极2支;50 mL烧杯3只;半电极管1支; 吸气球1只;导线若干。
(1)UJ24型电位差计
其面板如图5所示。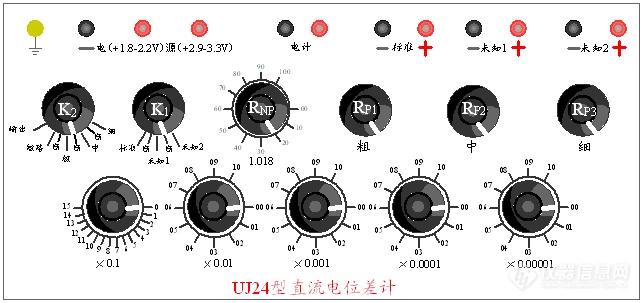
图5 UJ24型电位差计面板图
(1)工作电流调节部分( , , )
(2)标准电池电动势补偿部分( )
(3)测量回路部分(Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ)
(4)测量转换开关(K1)
(5)检流计开关(K2)
(6)接线端钮组
(2)检流计
检流计通常分为指针式和圈转式两种。前者的灵敏度一般为10-6A/分度,后者又分为单程光点反射检流计和复射式光点检流计,其灵敏度分别为10-7-10-8A/分度和10-8-10-10A/分度。检流计的作用是:主要用于以直流电工作的电测仪器(如电位差计、电桥等)中指示平衡(示零)之用,有时也用于热分析或光-电系统中测量微小的电流值。目前,较常用的是复射式光点检流计,其基本结构如图6所示。
第8楼2005/11/18
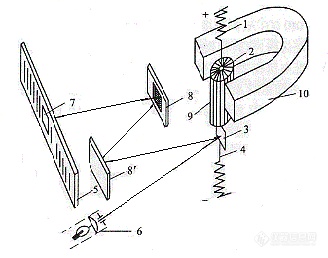
图6 复射式光点检流计结构示意图
1 弹簧片;2活动线圈;3平面镜;4吊丝;5标尺;
6光源;7准直线;8、8 反射镜;9铁心;10永久磁铁
检流计的工作原理与电流表的类似。弹簧片1通过吊丝4将活动线圈2悬于永久磁铁10的磁极与铁心9的空隙中,线圈下固定一平面镜3,可随线圈一起转动。由白炽灯、透镜和光栅构成的光源6发射出一束光,投射在平面镜3上,再反射至反射镜8、8,最后成象在标尺5上,光象中有一根垂丝线,它在标尺上的位置反映了线圈的偏转角度。当线圈中通过微小电流时,线圈在磁场力作用下带动平面镜转动,转动角经反射镜放大后可看到光点在标尺上移动。被测电流大小与偏转角度成正比,由此可十分灵敏地测出极微弱的电流。
当检流计与电位差计联用时,要注意两者间灵敏度的匹配。例如,UJ-25型电位差计最小的电压分度为10-6 V,若待测的原电池内阻为1000 Ω,则要求与之匹配的检流计必须能检出的最小电流应为 =10-9 A。因为检流计的标尺是以mm为最小分度,所以要求检流计的灵敏度应为10-9 A∙mm-1。AC15-4型光点检流计即可满足此要求。
此外,实验室中也常用指针式的平衡指示仪。它的基本原理是利用运算放大器,将微弱直流电经放大后输入灵敏的检流系统,采用大面积的指针式表头代替光点式检流。其优点在于读数稳定、清晰(尤其在室内光线比较明亮的情况下),抗干扰能力强,精度也相当高。如ZH2-B平衡指示仪即为一例。