“第四届原创”+《液质联用技术测定蜂王浆及蜂王浆冻干粉中多种抗生素残留》
液质联用技术测定蜂王浆及蜂王浆冻干粉中多种抗生素残留
摘要:建立了一种标准加入法同时测定蜂王浆及蜂王浆冻干粉中林可霉素、红霉素、替米考星、泰乐菌素、克林霉素、螺旋霉素、吉它霉素和交沙霉素等八种抗生素残留的新方法。用Tris提取液提取蜂王浆和蜂王浆冻干粉中八种抗生素的残留,经固相萃取柱分离、净化后,通过高效液相色谱分离、电喷雾串联四级杆质谱检测,外标法定量。研究发现,该实验条件下,八种抗生素在0.04 ng~1.00 ng之间呈线性关系,线性相关系数γ>0.9970;蜂王浆八种抗生素和蜂王浆冻干粉中的林可霉素、红霉素、克林霉素、泰乐菌素和交沙霉素方法检出限(LOD)为2.0µg/kg,蜂王浆冻干粉中替米考星、螺旋霉素、吉它霉素方法检出限(LOD)为5.0µg/kg。回收率在72.5%~110.0%;RSDr在1.65%~6.11%, RSDR在7.95%~14.94%之间,满足检测要求。
关键词:蜂王浆;蜂王浆冻干粉;大环内酯;SPE;HPLS-MS-MS;
中图分类号:O 657.7 文献标识码:A 文章编号:
作为预防和治疗蜜蜂病害用药,抗生素一般有较强的抗革兰氏阳性菌及某些革兰氏阴性球菌活性[1,2],可造成蜂王浆及蜂王浆冻干粉中存在残留。基于世界各国对抗生素药物残留均有严格的限量要求[3,4],建立蜂王浆及蜂王浆冻干粉中抗生素的多残留方法是十分必要的。
据文献报道,主要分析方法微生物法[5]、荧光光度法[6]、紫外分光光度法[7]、气相色谱[8]、薄层谱法[9]、高效液相色谱法[10~13]、毛细管电泳法(CE)[14]和液质联用技术LC-MSn法[15~19]法。
前处理采用缓冲溶液提取与固相萃取,采用液相色谱-串联质谱方法检测组合方法,灵敏度高、选择性和特异性好,能够对低浓度的样品进行很好的定性确认[20~28]。文献报道的测定方法多应用于动物、食品中[22~28],蜂王浆及蜂王浆冻干粉中同时测定多种类抗生素残留方法未见报道。
在参考以上文献的基础上,建立了用pH为9的Tris缓冲溶液提取蜂王浆和蜂王浆冻干粉及其制品中8种抗生素残留、Oasis HLB固相萃取柱萃取、净化,标准加入法,LC-MS-MS检测林可霉素、红霉素、替米考星、泰乐菌素、螺旋霉素、吉它霉素、克林霉素和交沙霉素残留的新方法。经过4年的使用证明[29],该方法有效克服了基质干扰。蜂王浆8种抗生素检出限达到2.0µg/kg;蜂王浆冻干粉中的林可霉素、红霉素、克林霉素、泰乐菌素和交沙霉素达到2.0µg/kg,替米考星、螺旋霉素、吉它霉素达到5.0µg/kg。低于国际上该类药物残留限量的检测要求。
1 实验
1.1 主要试剂
水为GB/T 6682规定的一级水;甲醇,乙腈:色谱纯;乙酸铵,盐酸,三羟甲基氨基甲烷(Tris,C4H11NO3),氯化钙:CaCl2•2H2O:优级纯;甲醇溶液(2+3),0.01 mol/L乙酸铵溶液,定容液为0.01 mol/L乙酸铵-乙腈溶液(17+3),Tris提取液(依次溶解12.0 g三羟甲基氨基甲烷和7.35 g氯化钙于水中,用盐酸调节pH=9,定容于1000 ml),
标准物质:林可霉素(CAS 7179-49-9。lincomycin,LIN)、红霉素(CAS 59319-72-1。erythromycin,ERY)、替米考星(CAS 108050-54-0。tilmicosin,TIM)、泰乐菌素(CAS 74610-55-2。tylosin,TYL)、螺旋霉素(CAS 8025-81-8。spiramycin,SPI)、克林霉素(CAS 21462-39-5。clindamycin,CLI)、吉它霉素(CAS 1392-21-8。kitasamycin,KIT)和交沙霉素(CAS 16846-24-5。josamycin,JOS)纯度≥95%。
单标溶液:1 000 μg/mL。各准确称取各种标准物质(按纯度折合为100%)0.0100 g于10.0 ml容量瓶中,用甲醇定容。并根据需要,经过适当稀释至浓度为10.0 μg/mL的标准工作溶液。
蜂王浆用基质标准混合工作溶液:分别吸取各浓度为10.0 μg/mL的单标标准工作溶液1.0 μL、2.0 μL、5.0 μL、25.0 μL标准工作溶液,依次加入相应的阴性样品中,按1.4步骤制备林可霉素、红霉素、替米考星、泰乐菌素、克林霉素、螺旋霉素、吉它霉素和交沙霉素分别为2.0 ng/mL 、4.0 ng/mL、10.0 ng/mL、50.0 ng/mL四个浓度水平的系列基质标准混合工作溶液;
蜂王浆冻干粉用基质标准混合工作溶液:分别吸取各浓度为10.0 μg/mL的单标标准工作溶液,分别吸取1.0 μL、2.0 μL、5.0 μL、25μL林可霉素、红霉素、克林霉素、泰乐菌素、交沙霉素标准工作溶液和2.5 μL、5.0 μL、10.0 μL、25μL的替米考星、螺旋霉素、吉它霉素标准工作溶液,依次加入相对应的阴性样品中,按1.4步骤制备林可霉素、红霉素、克林霉素、泰乐菌素、交沙霉素分别为2.0 ng/mL、4.0 ng/mL、10.0 ng/mL、50.0 ng/mL和替米考星、螺旋霉素、吉它霉素分别为5.0 ng/mL、10.0 ng/mL、20.0 ng/mL 50.0 ng/mL四个浓度水平的系列基质标准混合工作溶液。
1.2 仪器
液相色谱-串联质谱仪:AB 3200 Q TRAP配有电喷雾离子源(美国应用生物系统公司);固相萃取装置;氮气浓缩仪;滤膜:0.2μm;Oasis HLB固相萃取柱(500 mg,6 mL);天平,感量0.01 g,0.0001 g;具塞聚丙烯离心管,50 mL;离心机;超声波清洗仪;pH计;振荡器。
1.3 实验条件
1.3.1 液相色谱参考条件
色谱柱:Atlantis C18, 3 µm, 150 mm×2.1 mm;流动相A,乙腈;流动相B,0.1%甲酸溶液;流动相C,甲醇;流速:0.2 mL/min;柱温:30℃;进样量:20 µL。梯度洗脱条件见表1。
表1. 梯度洗脱条件
Table 1. Gradient conditions
| 时间/min A/% B/% C/% |
| 0.00 90.0 5.0 5.05.00 5.0 90.0 5.09.00 5.0 90.0 5.09.10 90.0 5.0 5.017.0 90.0 5.0 5.0 |
1.3.2 质谱条件参考条件
电喷雾离子源,正离子扫描,多反应监测,电喷雾电压5 500V,雾化气压力0.24 MPa,辅助气流速0.4 L/min,离子源温度550℃,碰撞室出口电压2.0 V;定性离子对、定量离子对、碰撞气能量和去簇电压,见表2。
表2. 8种抗生素的定性离子对、定量离子对、碰撞能量和去簇电压
Table 2. Precursor/ product ion combinations, collision energy and declustering potential,
of 8 macrolides
化合物名称 定性离子对(m/z) 定量离子对(m/z) 碰撞能量V 去簇电压V
林可霉素 407/126 407/126 37 50
407/359 24 50
克林霉素 688/158 688/158 70 30
688/544 42 30
红霉素 734/158 734/158 42 50
734/576 28 50
替米考星 869/174 869/174 62 90
869/132 70 90
泰乐菌素 916/174 916/174 54 80
916/145 55 80
螺旋霉素 843/142 843/142 48 60
843/174 50 60
吉它霉素 772/215 772/215 43 70
772/109 42 70
交沙霉素 828/174 828/174 45 80
828/109 45 80
1.4 样品处理
提取:称取2 g蜂王浆试样(蜂王浆冻干粉取1 g),精确至0.01 g,置于50 mL离心管中,加入10.0 mL tris提取液,于振荡器上剧烈振荡10 min。以18000 g离心力离心10 min,取上清液以小于1.0 mL/min的流速通过Oasis HLB固相萃取柱(使用前,依次用10 mL甲醇和10 mL水活化,在抽真空前的各步骤中,都保持柱体湿润)。再加入10.0 mL Tris提取液,于振荡器上剧烈振荡10 min。以18000 g离心力离心10 min,取上清液以小于1.0 mL/min的流速通过Oasis HLB固相萃取柱。
净化:待样液全部流出后,依次用10 mL水和10 mL甲醇溶液洗柱,弃去全部流出液,将固相萃取柱用真空泵减压抽干1 h;用10 mL甲醇洗脱于15 mL氮吹管中,用氮气于50℃水浴中吹至近干,准确加入1.0 mL定容液后,于超声波清洗仪中溶解残渣。过0.2 μm滤膜后,供液相色谱-串联质谱仪测定。
2 结果与讨论
根据前人研究资料,我们重点研究了提取液、样液浓缩、缓冲溶液、固相萃取柱、洗脱剂用量对结果的影响。
2.1提取溶液的选择
对不同pH条件下Tris溶液从蜂王浆中提取药物的效率进行了对比实验,实验结果见表3。
表3. 不同提取溶液的提取效果(峰面积)
Table 3. Different extraction solution returns-ratio
pH值 林可霉素 红霉素 替米考星 泰乐菌素 螺旋霉素 吉它霉素 克林霉素 交沙霉素
5.3 6920 3360 5250 51700 461 165 3030 418
6.0 8080 3510 5850 53800 498 681 4990 154
7.0 8170 12500 9750 118000 749 459 4540 69
8.0 10800 341000 34700 425000 18800 1080 1190000 449
8.5 16500 454000 31300 457000 15800 903 1360000 574
9.0 16300 569000 33000 533000 31700 1410 1440000 1120
9.5 16600 681000 31400 563000 29500 1210 1430000 1070
从表中数据可以看出,提取液的pH条件对蜂王浆中提取药物的效率有很大影响。林可霉素在pH条件范围8.5、9.0、9.5之间没有明显变化,在pH条件范围8.0、8.5、9.0、9.5之间没有明显变化,红霉素随着pH的增加而增加;替米考星在pH条件范围8.0、8.5、9.0、9.5之间没有明显变化,测定泰乐菌素在pH条件范围9.0、9.5之间没有明显变化,螺旋霉素在pH为9.0时最高,吉它霉素在pH为9.0时最高,克林霉素在pH条件范围9.0、9.5最大,交沙霉素最合适的pH条件范围是在9.0、9.5之间;所以本方法采用pH为9的Tris溶液作为提取液。
2.2 液相色谱-串联质谱测定质谱条件
用系列基质混合标准工作溶液,分别进样。在仪器最佳工作条件下,以基质混合标准工作溶液浓度为横坐标,以峰面积为纵坐标,绘制标准工作曲线。用标准工作曲线对样品进行定量,样品溶液中八种抗生素的响应值均应在仪器测定的线性范围内。在上述色谱条件和质谱条件下,八种抗生素的参考保留时间分别为林可霉素6.96 min、红霉素8.06 min、替米考星8.36 min、泰乐菌素8.48 min、克林霉素8.51 min、螺旋霉素8.67 min、吉它霉素8.83 min和交沙霉素9.14 min。
2.3、线性范围和测定低限
用空白基质溶液配制不同浓度的混合标准溶液,在选定的条件下进行测定,进样量为20 μL,用峰高对标准溶液中各被测组分的浓度做图。林可霉素、红霉素、替米考星、泰乐菌素、螺旋霉素、克林霉素、吉它霉素和交沙霉素的绝对量在0.04 ng~1.00 ng范围内均呈线性关系,其线性方程和相关系数见表4。
表4. 线性方程和相关系数
Table 4. Range and repeatability and reproducibility
化合物名称 检测范围(ng/mL) 线性方程 相关系数
林可霉素 2.0~50.0 Y=0.175 X+0.034 0.9977
红霉素 2.0~50.0 Y=0.0902 X+0.035 1.0000
替米考星 2.0~50.0 Y=0.0848 X+0.057 0.9991
泰乐菌素 2.0~50.0 Y=0.0903 X+0.0327 1.0000
螺旋霉素 2.0~50.0 Y=0.00659 X+0.0016 0.9988
克林霉素 2.0~50.0 Y=0.01659 X+0.0044 0.9988
吉它霉素 2.0~50.0 Y=0.0119 X+0.00282 0.9992
交沙霉素 2.0~50.0 Y=0.0469 X+0.0329 0.9970
该方法操作条件下,八种抗生素在添加水平2.0 µg/kg~50 µg/kg范围时,响应值在仪器线性范围之内,信噪比S/N大于5,林可霉素、红霉素、替米考星、泰乐菌素、克林霉素、螺旋霉素、吉它霉素和交沙霉素的基质标准定量限LOQ(a)、定量限添加LOQ(b)和空白样品(c)检测多反应检测(MRM)图分别见下图中的图1、图2、图3、图4、图5、图6、图7、图8。
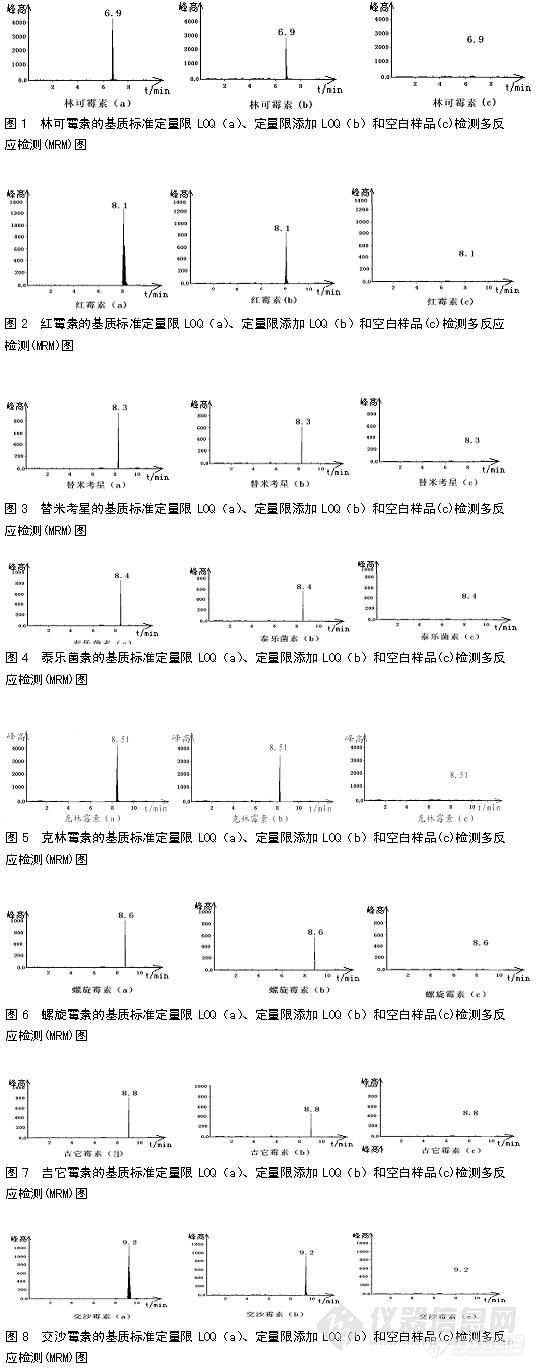
2.5、方法的正确性
我们采用本方法分别对蜂王浆中八种大环内酯抗生素在1 LOD(2.0 µg/kg)、2 LOD(4.0 µg/kg)、4 LOD (8.0 µg/kg)、10 LOD (20.0 µg/kg)四个添加水平,蜂王浆冻干粉在1 LOD(林可霉素、红霉素、克林霉素、泰乐菌素和交沙霉素均为2.0µg/kg,替米考星、螺旋霉素、吉它霉素均为5.0µg/kg)、2 LOD(林可霉素、红霉素、克林霉素、泰乐菌素和交沙霉素均为4.0µg/kg,替米考星、螺旋霉素、吉它霉素均为10.0µg/kg)、4 LOD(林可霉素、红霉素、克林霉素、泰乐菌素和交沙霉素均为8.0µg/kg,替米考星、螺旋霉素、吉它霉素均为20.0µg/kg)、10 LOD(林可霉素、红霉素、克林霉素、泰乐菌素和交沙霉素均为20 µg/kg,替米考星、螺旋霉素、吉它霉素均为50 µg/kg)四个添加水平,对8种抗生素进行添加回收率实验,其分析结果见表7。
表7. 方法的适用性添加回收率(%)
Table7 Method serviceability (Returns-ratio %,n=10)
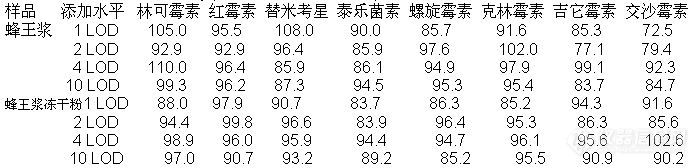
表7数据证明,在八种抗生素出峰区域未见干扰峰,样品的四个添加水平回收率在72.5%~110.0%之间;所做空白样品实验也表明,对于蜂王浆和蜂王浆冻干粉样品,本方法的适用性很好。
本方法经8个实验室进行重复性和再现性验证。用不含八种抗生素的蜂王浆样品分别做2.0 µg/kg、4.0 µg/kg、8.0 µg/kg、20.0 µg/kg四个水平的添加回收率实验,验证结果见表8。
表8-1. 8个实验室验证实验统计表(8个实验室,每个水平双平行)(μg/kg)

r-m回归方程 lg r=1.0319 lg m-1.0199 lg r=0.9962 lg m-1.0136 lg r=1.2925 lg m-1.2341 lg r=0.8905 lg m-1.0104
R-m回归方程 lg R=1.1879 lg m-0.6782 lg R=0.9399 lg m-0.4795 lg R=1.0931 lg m-0.5760 lg R=0.9828 lg m-0.5994
表8-2. 8个实验室验证实验统计表(8个实验室,每个水平双平行)(μg/kg)

r-m回归方程 lg r=1.0276 lg m-1.1067 lg r=1.0798 lgm-1.1495 lg r=0.9403 lg m-1.0077 lg r=0.8163 lg m-0.9362
R-m回归方 lg R=0.8969 lg m-0.4389 lg R=0.8854 lgm -0.4146 lg R=0.9771 lg m-0.5434 lg R=0.9073 lg m-0.5037
按照国家标准GB/T 6379《测试方法的精密度 通过实验室间试验确定标准测试方法的重复性和再现性》进行精密度数据统计,全部实验数据经格拉布斯(Grubbs)法、科克伦(Cochran)法、狄克逊(Dixon)法检验未发现异常值。八种抗生素重复性相对标准偏差(RSDr)在1.7%~17.8%之间,八
种抗生素再现性相对标准偏差(RSDR)在2.2%~14.9%之间,均符合国际AOAC标准分析方法对国际协同研究实验室内与实验室间重复性相对标准偏差和再现性相对标准偏差之要求。
3 结论
LC-MS-MS同时测定蜂王浆及蜂王浆冻干粉中林可霉素、红霉素、克林霉素、泰乐菌素、交沙霉素、替米考星、螺旋霉素、吉它霉素抗生素残留量的检测方法研究,方法的重复性相对标准偏差(RSDr)、再现性相对标准偏差(RSDR)符合国际AOAC标准分析方法要求,操作简单、回收率稳定、灵敏度高、选择性好、定量同时可以定性,可以满足世界各国对蜂王浆及蜂王浆冻干粉中该类药物残留的检测要求。





