

附件:
平凡人
第1楼2011/12/17
选择题
1.某采样过程中对1000吨炼焦用精煤进行采样,需要子样数目( C )
A.30 B .60 C.15 D.20
2.煤量不足300吨时,炼焦用精煤,其他洗煤及粒度大于100mm的块煤应采取子样数最少为( D ) A .4 B.5 C.8 D.6
3.下列那个采样工具可以进行矿石的样品采集( C )
A.自动采样品 B.取样铲 C.舌形铲 D.双套取样管
4.常用的化学干燥剂有多样。下面其中那种化学品不属于化学干燥剂( D )
A CaCl2 B H2SO4 C 无水K2CO3 D 无水Na2Co3
5.碱溶浊一般用质量分数为( B )的NaoH溶液做溶剂
A. 15﹪ B. 25﹪ C. 40﹪ D .45﹪
6.酸溶浊中常用的酸做溶剂( C )
A.高氯酸 B硝酸. C .焦硫酸钾 D.硫酸
7.分解重晶石(BaSO4)时用那种碱做溶剂( A )
A.NaCO3和K2CO3 B.Na2O2 C.NaOH D.KOH
8.当在熔融浊中当有有机物村在时使用那种溶剂极易发生爆炸(B )
A K2C2O7 B. Na2O2 C.KHSO4 D.K2CO3
9.常用作溶剂的酸不包括那个( D )
AHCl BH3PO4 C.HF D.H2CO3
10.在固体样品中一般要求分析试样能通过( B )号筛
A20---50 B100---200 C 50---100 D150---300
11.下列哪项不属于硅酸盐分析主要的测定项目( D )
A SiO2 B Fe2O3 C .Ti02 DNa2CO3
12.若用酸溶法测定硅酸盐试样中的Si02含量时一般选用的溶剂为( A )
A .HCL B H2SO4 C HNO3 D H3PO4
13.一般化学分析试验所用水为( A )
A..三级水 B. 二级水 C.一级水. D纯水
14.( C)不可储存,要现用现制备
A. 三级水 B. 二级水 C.一级水. D纯水
15.标注滴定溶液在常温(15℃--25℃)下保存时间一般不超过( C )
A. 15天 B. 1个月 C.两个月 D.半年
16.( A )标准物质有国家最高计量行政部门批准,颁发并授权生产
A 一级 B 二级 C 三级 D。四级
17.在标定和使用标准滴定溶质时,滴定速度一般保持在( B )
A5—7ml/min. B. 6—8ml/min C. 5—6ml/min D.7—8ml/min
18.下列哪种物质不属于高纯试剂纯度标准物质( D )
A.碳酸钠 B .EDTA C .重铬酸钾 D.硼砂
19.用于标定物质滴定溶液浓度的试剂为( D )
A.PH工作基准试剂 B 制备标准滴定溶液用试剂
C制备标准溶液用试剂 D。容量工作基准试剂
20.测量硅酸盐试样中SiO2含量且含量较少时一般采用( C )
A.熔融法 B。烧结法 C 。酸溶法 D.气化法
21已知高锰酸钾标准溶液C1/5=0.01mol/l,则CKMN04=( A )
A .0.002 mol/l B 0.02 mol/l C 0.001 mol/l D.0.01 mol/l
22.在紫外—可见分光光度计中,放大器各挡的灵敏度中“ 2 ”代表( B )
A.*1倍 B .*10倍 C. *2倍 D.*20倍
23.透光度T与吸光度关系( A )
A.A=㏒1/T B.T=㏒1/A C. A=1/T D A-T
24.在分光光度计中,打开试样室盖,调节( A )选钮
A.“0” B .100 ﹪ C .50﹪ D 75﹪
25.测用手持微型电导率仪测水样的电导率时应立即测定,否则空气中二氧化碳溶于水中使水的的电导率( A )
A .增大 B。不变 C。减小 D。不变化
26.氯离子的检验:取水样100ml于试管中,加入AgN03水溶液均匀若出现( )沉淀则证明有氯离子。A 红 B蓝 C 白 D黄
27.下列玻璃量器的是( A )
A.抽滤瓶 B。比色管 C .吸收管 D.移液管
28.短时间使用酸度计测量,预热时间为( A )
A.十几分钟. B.二十几分钟 C.1h D.几分钟
29.下列物质中常用作基准物质来标定NaoH的量( A )
A.邻苯二甲酸氢钠 B.磷酸 C.硼砂. D.笨酸
30.高锰酸钾溶液呈紫色时因为它吸收了白光中的( A )
A .绿 B 蓝 C.黄 D.紫
31.样品保留量根据样品全分析用量而定,不少于两次全分析量,固体成品的料保留( C )
A. 600g B. 300g C 500g D.700g
32根据留样管理要求,成品固体一般保留( C )
A.一周 B.一个月 C.6个月 D一年
33.下列论述中错误的是( D )
A.方法误差属于系统误差 B。系统误差包括操作误差
C系统误差又成称可测误差. D.系统误差呈正态分布
34.对一试样进行测定,获得其中某物质的含量的平均值为3.25﹪,则其中任一测定值(如3.15﹪).与平均值只差为该次测定的( A )
A.绝对误差 B.相对误差 C.相对偏差 D.标准偏差
.35.国家一级标准物质稳定时间应为( A )
A.两类 B.三类 C.四类 D。五类
平凡人
第2楼2011/12/17
1EDTA分子具有 个配位原子(B)
A 4 B 6 C 7 D 5
2将PH等于13.0的NAOH与PH等于1.0的盐酸溶液混合,混合后溶液的PH为()
A 12.0 B 7.0 C 8.0 D 6.5
3缓冲溶液总浓度一定,缓冲组分比等于 时,缓冲能力最强(C)
A 0.1 B 0.5 C 1 D 10
4国家标准规定使用 指示剂作为工业硫纯度测定的指示剂(C)
A甲基红 B酚酞 C甲基红-亚甲基蓝指示剂 D甲基橙
5测定烧碱NAOH和Na2CO3含量时,NAOH消耗HCL标准滴定溶液的体积是(B)
A V 1 B V 1- V 2 C V 1 + V 2 D 2V2
6已知HCOOH的PKa=3.75,c=0.20mol/L,HCOOH溶液PH为(A)
A 2.22 B 3.58 C 1.32 D 4.68
7当NAOH滴定HCL的滴定突越为4.3~9.7时 指示剂不能作为此滴定的指示剂(B)
A 甲基橙 (3.1~4.4) B甲基黄(2.9~4.0) C 溴百里酚蓝(6.0~7.6) D 酚酞(8.0~9.6)
8NH3能 组成缓冲溶液(A)
A NH4CL B HAC C NaAC D HCL
9下列那种测定不能用酸碱滴定法(D)
A食醋中总酸量的测定 B氨水中氨含量的测定 C烧碱中NAOH和Na2C03 D水硬度的测定
1010能与金属离子生成有色配合物的显色剂是()
A金属指示剂 B酸碱指示剂 C氧化还原指示剂 D吸附指示剂
11溶液中有AL3﹢和Zn2﹢时,在PH等于5.5的酸性溶液中,可用 掩蔽AL3﹢以滴定ZN2﹢(B)A EDTA B NH4F C甲醛 D KCN
12下列哪种方法不属于氧化还原滴定法(C)
A高锰酸钾法 B重铬酸钾法 C佛尔哈德法 D碘量法
13Cu合金中Cu含量的测定用(A)
A间接碘量法 B直接碘量法 C重铬酸钾法 D氧化还原法
14高铬酸法用 作指示剂()
A 淀粉 B二苯胺 C二苯胺磺酸钠 D不加指示剂
15下列指示剂中不属于金属指示剂的是()
A铬黑T B甲基橙 CPAN D磺基水杨酸钠
16在铁矿石中铁含量的测定实验中所有的指示剂是(B)
A二苯胺 B二苯胺磺酸钠 C邻苯氨基苯甲酸 D次甲基蓝
17在沉淀滴定法中,莫尔法是以 做为指示剂,用AgNO3标准溶液测定卤素化合物含量的方法(A)
A KMNO4 B K2CrO4 C MnO2 D K2MnO4
18莫尔法测定的最适宜的PH范围(B)
A 3.5~5.5 B 6.5 ~10.5 C 7.5~12.5 D 3.5~12.5
19应用佛尔哈德法时常在酸溶液中进行滴定,通常 HNO3中进行(A)
A 0.1~1mol/L B 0.5~2mOL/L C 0.1~3mol/L D1~2Mol/l
20灼烧是将沉淀物在 温度下热处理 (B)
A 300~1500℃ B 250~1200℃ C 400~1300℃ D 250~1500℃
21在沉淀滴定法中,莫尔法是以 做为指示剂,用AgNO3标准溶液测定卤素化合物含量的方法(A)A KMNO4 B K2CrO4 C MnO2 D K2MnO4
22莫尔法测定的最适宜的PH范围(B)
A 3.5~5.5 B 6.5 ~10.5 C 7.5~12.5 D 3.5~12.5
23应用佛尔哈德法时常在酸溶液中进行滴定,通常 HNO3中进行(A)
A 0.1~1mol/L B 0.5~2mOL/L C 0.1~3mol/L D1~2Mol/l
24灼烧是将沉淀物在 温度下热处理 (B)
A 300~1500℃ B 250~1200℃ C 400~1300℃ D 250~1500℃
25用强酸性阳离子交换树脂分离K﹢﹑Na﹢﹑li﹢等离子,当用0.1MOL/LHCL溶液淋洗时洗脱顺序为(C)
A K﹢﹑Na﹢﹑li﹢ B K﹢ ﹑li﹢ ﹑Na﹢ C li﹢ ﹑Na﹢﹑ K﹢ D li﹢ K﹢﹑Na﹢
26下列不属于银量法的是(D)
A莫尔法 B佛尔哈德法 C法扬司法 D沉淀重量法
27溶液萃取分离法选择萃取剂错误的是(A)
A沸点高,便于分离后浓缩 B密度大小适宜,便于两相分层
C性质稳定,毒性小 D溶剂纯度高
28白光是 范围内各种波长光的混合光(D)
A 460~700nm B 500~700 nm C 360~ 700 nm D 400~700 nm
29有机化合物在紫外-可见区产生吸收的前提条件是(B)
A有不饱和官能团 B存在轨道 C可使其发生跃迁的能量 D无需条件
30下列官能团中不属于发色团的是(D)
A -C=O B -C三C- C -N=O D-OH
31电位滴定法与一般滴定法的根本区别在于(C)
A名称不同 B方法不同 C确定终点的方法不同 D原理不同
32下列说法不正确的是(C)
A直接电位法应用广范 B电位滴定法准确度比化学滴定法低
C直接电位法是由电池电动势计算溶液浓度的 D玻璃电极是一种离子选择性电极
33下列属于参比电极的是(C)
A玻璃膜电极 B生物电极 C甘汞电极 D气敏电极
34用硝酸银溶液滴定含溴离子的溶液时,可选用的参比电极有(B)
A银电极 B双盐桥甘汞电极 C汞电极 D石墨电极
35下列不是一氯化银电极特点的是(D)
A体积小 B灵活 C可以在高于60℃的体系中使用 D不随温度变化而变化
36玻璃电极的特性中不包括(B)
A不对称电极 B对称电极 C碱差 D酸差
37玻璃电极在使用前一定要在水中浸泡二十四小时,其目的是(A)
A活化电极 B清洗电极 C校正电极 D除去玷污的杂质
38在点位法中作为指示电极,其电位应与被侧离子的浓度()
A无关 B符合能斯特公式的关系 C成正比 D符合扩散电流公式的关系
39当金属插入其盐溶液时,金属表面和溶液界面间形成了双电层,所以产生了电位差,这个电位差叫做(B)A直接电位 B 电极电位 C电动势 D 膜电位
40用EDTA溶液电位滴定CO2﹢溶液时,可选用的指示电极为(D)
A玻璃电极 B 晶体膜铜电极 C铂电极 D晶体膜铜电极加Cu2﹢-EDTA溶液
平凡人
第3楼2011/12/17
判断题
1.能斯特方程式中氧化型的浓度包括OHˉH﹢等的浓度。( √ )
2.温度对氧化还原反应的速度几乎无影响。(× )
3.专属指示剂自身就是一种氧化剂或还原剂。( ×)
4.高锰酸钾是一种强氧化剂,介质不同,其还原产物也不一样。( √ )
5.间接碘量法中淀粉指示剂的加入时间根据个人习惯而定。( × )
6.溴酸钾法主要用于有机物的测定。( √ )
7.配制I2标准溶液时,加入KI的目的是增大I2溶解度以降低I2的挥发性和提高淀粉指示剂的灵敏度。( √ )
8.影响氧化还原反应速度的主要因素有反应物的浓度,酸度,温度和催化剂。( √ )
9.KMNO4溶液作为滴定剂时,必须装在棕色酸式滴定管中。( √ )
10.在用草酸钠标定高锰酸钾溶液时,溶液加热的温度不得超过45℃。( × )
11.EDTA配位滴定主要应用于无机物的定量分析。( √ )
12.溶液的PH值越小,金属离子与EDTA配位反应能力越底。( √ )
13.金属指示剂的封闭是由于指示剂与金属离子生成的配合物过于稳定造成的(
14.用掩蔽法提高配位滴定的选择性,其实质是降低干扰离子的浓度。( √ )
15.配合物的稳定常数K稳为一不变的常数,它与溶液的酸度大小无关。( √ )
16.佛尔德法通常在0.1—1mol/l的HNO3溶液中进行。( √ )
17.吸附指示剂是利用生成化合物的种类不同来指示滴定终点。( × )
18.莫尔法中,滴定时的应剧烈摇动以免产生吸附而产生较大。( √ )
19.移液管转移溶液后,残留在其中的溶液量不同是偶然误差。( √ )
20.实验中可用直接法配制HCL标准溶液。( × )
21.薄层色谱法分离时,吸附剂的极性和活性都要适当。( √ )
22.在萃取分离中,只要分配比大,萃取效率就高。( × )
23.对某一种组分的分析,只有一种方法是正确的 。( × )
24.分析工作者在选择分析方法时,主要应遵循节约的原则,分析的成本越低越好。( √ )
25如果把适当颜色的两种光按一定强度比列混合,也可以成为白光,这两种颜色的光称为互补色光,如绿色光与紫红色光互补。( √ )
26.朗伯-比尔定律的应用条件:一是必须使用单色光;二是吸收发生在均匀的介质,三是吸收过程中,吸收物质相互不发生作用。( √ )
27.在分光光度分析中,入射光强度与透射光强度之比成为吸光度,吸光度的倒数的对数为透光率。( × )
28.有色溶液的吸光度为0 ,其透光率也为0( × )
29透光物质不吸收任何光,黑色物质吸收所有光。( √ )
30玻璃电极在使用前需要在蒸馏水中 听跑24h以上,目的是清洗电极。( × )
平凡人
第4楼2011/12/17
简答题
1. 选择酸碱指示剂的原则是什么?
2. 氧化还原滴定法所使用的指示剂有几种类型?举列说明?
3. 什么叫回收率?分离时对常量和微量组分的回收率的要求如何?
4. 朗伯比尔定律为什么只有在稀溶液中才能成立?
5. 什么是液-液萃取分离?它有什么特点?
6. 如何减小随机误差?
7. 分光光度计灵敏度档的选择原则是什么?
8. 发生化学灼伤时应如何处理?
9. 标准缓冲溶液如何制备?
10. 选择萃取条件时应考虑那些应素?
简答题答案
1. 指示剂的变色范围全部或大部分落在滴定突跃范围
2. 有三种类型;(1)自身指示剂,如高锰酸钾;(2)氧化还原指示剂,如次甲基蓝;(3)专属指示剂,如可溶性淀粉
3. 欲测组分的回收率,是指欲测组分经分离或富集后所得到的含量与它在试样中原始含量的比值。对常量组分的测定,要求回收率大于99.9﹪;而对于微量组分的测定,回收率可为95﹪,甚至更低。
4. 由于在高浓度时,(通常C>0.01mol/l),吸收质点之间的平均距离缩小到一定程度,邻近质点彼此的电荷分布都会相互受到影响,此影响能改变它们对特定辐射的吸收能力,相互影响程度取决与C,因此,此现象可导致A与C线性关系发生偏差。
5. 液-液萃取分离法,简称萃取分离法,它们是利用物质在两种不互溶溶剂中溶解度的差异,达到分离纯化目的一种分离试样的方法。该法所需仪器设备简单,操作比较方便,分离效果好,既能用于大量元素的分离,又适合于微量元素的分离与富集。
6. 进行多次平行测定。
7. 在保证用空白溶液能较好调到100﹪透光度的情况下应尽可能采取用灵敏度较低挡,这样仪器稳定性高。
8. 化学灼伤时,应迅速解开衣服,清除皮肤上的化学药品,并用大量赶紧的水冲洗。
9. 1)PH标准缓冲溶液是用PH工作基准试剂,经干燥处理,用超纯水,在20℃±5℃条件下配制的。其组成标度用溶质B的质量摩尔浓度 bB表示。可用于仪器的校正。定位。
2)PH值的测定用缓冲溶液可用优级纯,实验室三级纯水配制。其组成标度用物质的两浓度cB表示。主要他、用于用电位法测定化学试剂水溶液的PH值。测定范围PH=1-12
10.(1)溶剂纯度要高,减小因溶剂而引入杂质;(2)沸点宜低,便于分离后浓缩;(3)被萃取物质在萃取剂的完全成度要大,而杂质在其中的溶解要小;(4)密度大小适宜,易于两相分层;(5)性质稳定,毒性小
平凡人
第5楼2011/12/17
计算题
1. 一个学生把蒸馏水空白的透射比标尺放在98﹪误以为100﹪,在此情况下测得有色溶液的透射比为45.7﹪.计算该有色溶液正确的透射比为多少?
解: 98﹪/100﹪=45.7﹪/X X=46.6﹪
2.50ml含Cd2+ 5.0ug 的溶液,用平啉显色剂后于428nm波长 用0.5cm比色皿测得A=0.46.求摩尔吸收系数。
解 :根据伯朗-比尔定律知: A=Kbc
C= 5.0ug/.50ml=50mg/50l=0.005/112.41/50 =8.9*10ˉ7
K=A/bc=0.46/0.5*8.9*10ˉ7=1.03*10+6
3.测定含镍矿渣中镍的含量。称取试样0.6261g.分解后转移入100ml容量瓶,吸取2.0ml试液置于100ml容量瓶中,在与工作曲线相同条件下显色,测得溶液的吸光度A=0.300,求矿渣中的镍的质量分数。
解:
镍浓度g/l 0.0 0.2 0.4 0.6 0.8 1.0
吸光度A 0.0 0.120 0.234 0.350 0.460 0.59
∑XiYi=0.0*0.0+0.2*0.120+0.4*0.234+0.6*0.350+0.8*0.460+1.0*0.59=1.286
∑Xi=3.0 ∑Yi=1.754 ∑Xi2=0.0+0.04+0.16+0.64+1=2.2 n=6
a=n∑XiYi-∑Xi*∑Yi/n∑Xi2-(∑Xi)2=6*1.286-3.0*1.754/6*2.2-9=0.584
b=y-ax=1.754/6-0.584*3.0/6=0.0003
得 y=0.584x+0.0003
吸光度A=0.300时,镍浓度 X=0.300-0.0003/0.584=0.513ug/ml
镍的质量分数=0.513ug/ml*100ml/0.628*2.0ml/100ml=4.1*10ˉ3
4.称取某可溶性盐0.1616g,用BaSO4重量法测定其含量硫量,称得BaSO4沉淀为0.1491g.计算试样中SO3质量分数。
解:F=Mso3/M BaSO4=80.06/233.39
SO3的质量分数=Mx*F/ms=0.1491*80.06/233.39/0.1616=0.3165
5.称取硅酸盐试样0.5000g.经分析后得到NaCL和KCL混合物质量为0.1803g.将混合物沉淀质量为0.3904g.计算试样中NaCL和KCL质量分数。
解:KCL质量分数为X NaCL质量分数为Y
则:样品中KCL质量=0.5000*X 样品中 NaCL质量=0.5000*Y
0.5000*X+0.5000*Y=0.1803
KCL→AgCL NaCL→AgCL
0.5000*X/MKCL*M AgCL+0.5000*Y/M AgCL=0.3904
0.5000*X/74.56*143.32+0.5000*Y/58.44*143.32=0.3904
联立方程组解得:X=0.1953 Y=0.1653
6.称取纯试样KIOx 0.5000g,经还原为碘的物质浓度小于0.1000mol/l,AgNO3标准溶液滴定,消23.36ml。求该盐的化学式。
解:MKIOx=Mk+MI+x*MO=39+127+16x=166+16x
nKIOx=nIˉ=n AgNO3
0.5000/MKIOx=C AgNO3*V AgNO3
0.5000/166+16x=0.1000*0.02336 解得X=3
7.将40.00ml 0.1020mol/l AgNO3溶液加到25.00ml BaCL2溶液中,剩余的AgNO3溶液需要15.00ml 0.09800mol/l NH4SCN溶液滴定,向25.00mlBaCL2溶液中会BaCL2质量分数为多少?
解:n AgNO3=2nBaCL2+nNH4SCN
n AgNO3=0.1020*0.040 nBaCL2=0.0025*C BaCL2 nNH4SCN=0.09800*0.015
C BaCL2=0.0102*0.04-0.09800*0.015/2*0.025
mBaCL2=0.0102*0.04-0.09800*0.015/2*0.025*208.24*0.025/2*0.025=0.272g
8.准确移取25.00mlH2SO4溶液,用0.09026mol/lNaON溶液滴定,到达化学计量点时,消耗NaOH溶液的体积为24.93ml,问H2SO4溶液的浓度为多少?
2NaOH+ H2SO4=Na2SO4+2H2O
c H2SO4*V H2SO4=1/2cNaOH* VNaOH
c H2SO4=0.0906mol/l*24.93ml/2*25.00ml=0.04500 mol/l
平凡人
第6楼2011/12/17
9.用二苯碳酰二肼分光光度法测定水中六价铬,校准曲线回归方程为y=0.1252x+0.002(y:吸光度; x: 六价铬的质量,ug)。若取5mL水样进行测定,测定吸光度为0.088, 空白测定吸光度为0.008。求水中六价铬的含量?
解:水样的校正吸光度为0.088-0.008=0.08
代入校准曲线回归方程,x=(0.08-0.002)/0.1252=0.623 ug
六价铬的含量(mg/L)=0.623/5=0.125
10:用分光光度法测定一水样中总铬时,所得标准曲线的数据为:
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
解:最小二乘法
水样测定的吸光值为0.095。在同一水样中加4.00ml铬标准溶液(1.0ug/mL)的量测定加标回收率。其吸光度为0.267。
试计算加标回收率(不考虑加标体积的影响)。
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
校正A 0.000 0.010 0.020 0.043 0.090 0.183 0.268 0.351 0.441
解:
最小二乘法
技能题
9.用二苯碳酰二肼分光光度法测定水中六价铬,校准曲线回归方程为y=0.1252x+0.002(y:吸光度; x: 六价铬的质量,ug)。若取5mL水样进行测定,测定吸光度为0.088, 空白测定吸光度为0.008。求水中六价铬的含量?
解:水样的校正吸光度为0.088-0.008=0.08
代入校准曲线回归方程,x=(0.08-0.002)/0.1252=0.623 ug
六价铬的含量(mg/L)=0.623/5=0.125
10:用分光光度法测定一水样中总铬时,所得标准曲线的数据为:
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
解:最小二乘法
水样测定的吸光值为0.095。在同一水样中加4.00ml铬标准溶液(1.0ug/mL)的量测定加标回收率。其吸光度为0.267。
试计算加标回收率(不考虑加标体积的影响)。
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
校正A 0.000 0.010 0.020 0.043 0.090 0.183 0.268 0.351 0.441
解:
最小二乘法 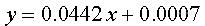
平凡人
第7楼2011/12/17
技能题
铬μg | 0.00 | 0.20 | 0.50 | 1.00 | 2.00 | 4.00 | 6.00 | 8.00 | 10.00 |
A | 0.007 | 0.017 | 0.027 | 0.050 | 0.097 | 0.190 | 0.275 | 0.358 | 0.448 |
校正A | 0.000 | 0.010 | 0.020 | 0.043 | 0.090 | 0.183 | 0.268 | 0.351 | 0.441 |
平凡人
第8楼2011/12/17
三KMnO4标准滴定溶液的配制与标定
实验目的:
1) 掌握高锰酸钾标准溶液的配制方法和保存条件。
2) 掌握用Na2C2O4作基准物质标定高锰酸钾溶液浓度的原理,方法条件。
实验步骤:
KMnO4标准溶液c(KMnO4)=0.02mol/l的配制 称取3.3g高锰酸钾,溶于1050ml水中,缓冲煮沸15min ,冷却后置于暗处保存两周。以G4玻璃砂芯漏斗或玻璃纤维过滤,除去MnO2杂质,溶液保存于干燥棕色瓶中,待标定。如果溶液经煮沸并在水浴上保温1h,l冷却后过滤,则不必长时间放置于可以标定其浓度。
3) KMnO4溶液的标定 准确称取0.15-0.20g已于105-110℃烘至衡重的基准物无水Na2C2O4 2-3份,分别放于250ml锥型瓶中,加30ml蒸馏水使其溶解,加入10ml 3mol/l的硫酸,加热到75-85℃趁热用待标定的KMnO4溶液滴定。开始滴定时,MnO-4离子消失较慢,待前一滴溶液褪色后,再加热第二滴,继续滴定至溶液呈分红色,并保持30s不褪色,即为终点.记下.
四醋总酸度的测定
实验目的
1) 学会食醋中总酸度的测定原理和方法。
2) 掌握指示剂的选择原则
3) 加强移液管的使用
4) 掌握强碱滴定弱酸的滴定过程,突跃范围及指示剂的选择原理。
实验原理;
食醋的主要成分是醋酸,此外还含有少量其他弱酸如乳酸等。用氢氧化钠标准溶液滴定,在化学计量点时溶液呈弱碱性,选用酚酞做作指示剂,测得的是总酸度,以醋酸的质量浓度(g/ml)
实验步骤:
1.0.06mol/l氢氧化钠溶液的配制和标定平行标定三次,计算氢氧化钠标准溶液的准确浓度,取平均值。
2.稀释食醋样品
用5ml吸量管准确移取5.00ml的食醋置于100ml容量瓶中,加蒸馏水至2/3体积,初步摇匀,之后定容至刻度。
3.用移液管吸取稀释后的食醋试样25.00ml.,移入250.ml锥形瓶中,加酚酞指示剂2滴,用NaOH标准溶液滴定至微红色,并半分钟不褪色即为终点。平行测定3次。记录NaOH标准溶液的用量。
五吸收曲线和摩尔吸光系数的测定分光光度法
一、实验目的
1、学习吸收曲线绘制方法;
2、学会选择最大吸收波长的方法;
3、学会测定摩尔吸光系数。
二、实验原理
用不同波长的光照射固定浓度和液层厚度的高锰酸钾溶液,并测定每一波长下溶液对光的吸收程度,即吸光度A,以吸光度为纵坐标,相应波长为横坐标,绘制作图,则得到吸收曲线。吸光度最强点所对应的波长称为最大吸收波长λmax ,把最大吸收波长作为工作波长,根据A=kbc测定高锰酸钾的摩尔吸光系数k,单位为Lmol-1cm-1。
三、实验试剂和仪器
1、0.02M KMnO4 (CKMnO4)
2、分析纯(A.R.) H2C2O4.2H2O
3、1cm比色皿
4、721分光光度计
四、实验步骤
1、 预处理
1) 用草酸标定高锰酸钾溶液,确定其准确浓度。
2) 稀释高锰酸钾溶液
移取2.00ml高锰酸钾溶液置于100ml容量瓶中,定容至100mL。
2、 绘制吸收曲线和选择最大吸收波长
将高锰酸钾置于1cm比色皿中,以蒸馏水为空白,在460~700nm之间,步长10nm,其中在500~540nm之间步长为5nm,分别测定吸光度A。每换一个波长必须重新校正吸光度为0,绘制吸收曲线,确定最大吸收波长λmax 。
3、 测定最大吸收波长处的摩尔吸光系数
以最大吸收波长为工作波长,测定高锰酸钾的吸光度,据郎伯—比尔定律计算摩尔吸光系数k。平行测定三次,取平均值。
记录数据和数据处理
平凡人
第9楼2011/12/17
六碘盐中KIO3含量的测定
分光光度法
一、 实验目的
学习分光光度法测定碘盐中KIO3含量的原理与方法。
二、 实验仪器与试剂
仪器:
1、721(或722型)分光光度计
2、50mL容量瓶
3、5mL吸量管、量筒等。
试剂和试样:
1、10mg/L KIO3工作液
2、0.1mol/L H2SO4溶液
3、碘盐
4、KI-淀粉混合液
KI-淀粉混合液的配制:2.5g可溶性淀粉加水溶解后倾入500mL沸腾的水中,煮至清亮,加入2.5gKI,溶解后用0.2mol/L NAOH(约2ml)调至pH达8~9。此液可稳定两周(25℃)。
KIO3工作液的配制:0.5000g KIO3溶于水,配成1L溶液,取1.00mL配成50mL。
三、实验原理
根据KIO3在酸性条件下能定量氧化KI:
IO3-+5I-+6H+=3I2+3H2O
反应生成的碘I2与淀粉作用形成蓝色的包合物,此包合物对595nm波长的单色光具有最大吸收,通过测定其对595nm波长光的吸光度A,可求得碘盐中的碘含量。
四、 实验步骤
1、 KIO3标准溶液的配制
准确吸取1.00、2.00、3.00、4.00、5.00mL浓度为0.01000g/L的KIO3工作液,分别放入50mL容量瓶中,然后各加入30mL0.1mol/L H2SO4,摇匀,再各加入2mLKI-淀粉混合液,显色后静置2min,稀释至50mL。以蒸馏水为参比,用1cm比色皿在595nm波长处测定吸光度Ax,绘制出工作曲线。
2、 试样的测定
称取1.000g碘盐,加水溶解后转移到50mL容量瓶中,同法加入H2SO4、KI-淀粉混合液,测定吸光度A,在工作曲线上查出A,对应的KIO3浓度CX (注意试液、标液应在同条件下同时显色,同时测定)。
五、 数据处理
w (KIO3,mg/Kg)=Cx*V/mx*106
Cx——g/L
V——盐溶液的总体积,mL
mx——盐样的质量,g
六、 思考题
1、 为什么光度法中,一般均选用有色物质的最大吸收波长作为测量波长?
2、 吸光光度法中,参比溶液的作用是什么?
3、 吸光光度法中,如何选择适宜的酸度条件和显色剂的用量?
4、 显色时要求KI过量,为什么?
5、 测定能在碱性条件下进行吗?为什么?
6、 用浓稠的淀粉液进行显色时,对结果有无影响?
七 水溶液pH的测定
一、 实验目的
1、 了解用直接电位法测定水溶液pH的原理和方法;
2、 掌握酸度计的操作方法。
二、 实验原理
水溶液的pH通常是用酸度计进行测定的。以玻璃电极作指示电极,饱和甘汞电极作参比电极,同时插入被测试液之中组成工作电池,该电池可以用下式表示:
(-) AgCl | HCl(0.1mol/L) | 玻璃膜 | 试液 ‖KCl(饱和) | Hg2Cl2 , Hg (+)
|← -----------玻璃电极 ----------------------→| |←-----饱和甘汞电极------→|
在一定条件下,工作电池的电动势可表示为 :E=K’=0.059pH(25℃) 。由测得的电动势虽然能算出溶液的pH,但因上式中的K’值是由内、外参比电极的电位以及难于计算的不对称电位和液接电位所决定的常数,实际计算并非易事。因此在实际工作中,当用酸度计测定溶液的pH时,经常用已知pH的标准缓冲溶液来校正酸度计(也叫“定位”)。校正时应选用与被测溶液的pH接近的标准缓冲溶液,以减少在测量过程中可能由于液接电位、不对称电位以及温度等变化而引起的误差。校正后的酸度计,可直接测量水或其它低酸碱度溶液的pH。
三、 仪器和试剂
1、 pHS—2型酸度计,玻璃电极与饱和甘汞电极。
2、 pH标准缓冲溶液(25℃):pH=4.00(0.05mol/L KHC8H4O4溶液);pH=6.86(0.025 mol/L KH2PO4和0.025 mol/LNa2HPO4的混合溶液);pH=9.18(0.01 mol/L Na2B4O7*10H2O溶液)。
四、 实验步骤
1、 按照酸度计说明书中的操作方法进行操作
摘取饱合甘汞电极的橡皮帽,并检查内电极是否浸入饱和KCl溶液中,如未浸入,应补充饱和KCl溶液,安装玻璃电极和饱和甘汞电极,并使饱和甘汞电极稍低于玻璃电极,以防止杯底及搅拌子碰坏玻璃电极薄膜。
2、 将电极和塑料杯用水冲洗干净后,用标准缓冲溶液荡洗1~2次(电极用滤纸吸干)。
3、 用标准缓冲溶液校正仪器。
4、 用水样将电极和塑料烧杯冲洗6~8次后,测量水样(或水溶液)。由仪器刻度表上读出pH值。测定样品:蒸馏水、自来水、稀酸、稀碱、汤河水样、渤海海水水样。
5、 测量完毕后,将电极和塑料烧杯冲洗干净,妥善保存。
五、 思考题
1、 电位法测水溶液pH的原理是什么?
2、 酸度计为什么要用已知pH的标准缓冲溶液校正?校正时要注意什么问题?
3、 玻璃电极在使用之前应如何处理?为什么?
4、 安装电极时,应注意哪些问题?
5、 有色溶液或浑浊溶液的pH是否可以用酸度计测定?
平凡人
第10楼2011/12/17
八常压蒸馏
一 、实验目的
1、掌握圆底烧瓶、直型冷凝管、蒸馏头、真空接受器、锥型瓶等的正确使用方法,蒸馏装置的装配和拆卸。
2、熟悉正确进行蒸馏操作和测定沸点的要领和方法。
二、仪器和试剂
1、仪器:蒸馏烧瓶、温度计、直型冷凝管、尾接管、锥型瓶、量筒、漏斗、沸石等。
2、试剂:70%乙醇(沸程77~79)。
三、实验步骤
1、加料:
将待蒸乙醇40ml小心到入蒸馏瓶中,不要使液体从支管流出,加入几粒沸石,塞好带温度计的塞子,注意温度计的位置。再检查一次装置是否稳妥与严密。
2、收集馏液:
准备两个接受瓶,一个接受前馏分或称馏头(温度达到沸点之前馏出的液体),另一个(需称重)接受所需馏分,并记下该馏分的沸程:即该馏分的第一滴和最后一滴时温度计的读数。
在所需馏分蒸出后,温度计度数会突然下降。此时应停止蒸馏。即使杂质很少,也不要蒸干,以免蒸馏瓶破裂及发生其他意外事故。
九索氏提取发处理土壤样品
一、 实验目的
1、掌握索氏提取器的使用方法。
2、熟悉索氏提取法处理土壤样品操作。
二、实验仪器
1、索氏提取器
2、水浴锅
3、玻璃器皿:300ml分液漏斗,300ml具塞锥形瓶,100ml量筒,250ml圆底烧瓶等。
三、实验试剂
1、石油醚,沸程60~90℃ 2、丙酮 (CH3COCH3)
3、无水硫酸钠:在300℃烘箱中烘烤4h,备用
4、硅藻土:试剂级。
5、硫酸钠溶液:20g/L
五、实验步骤
1、准备称取20g土壤置于小烧瓶中,加蒸馏水2ml,硅藻土4g,充分混匀,无损的移入滤纸桶内,上部盖一片滤纸,将滤纸筒装入索氏提取器中。
2、100ml石油醚-丙酮(1:1),用30ml浸泡土样12h。
3、在75~95℃恒温水浴上加热提取4h。
4、记录虹吸次数。虹吸5~6次后,当提取筒种提取液颜色变得很浅时,说明被提取物已大部分被提取,停止加热,冷却提取剂。
5、待冷却后,拆除索氏提取器,将提取液移入300ml的分液漏斗中,倾斜使其全部流到圆底烧瓶中。用10ml石油醚分三次冲洗提取器及烧瓶,将洗液并入分液漏斗中,加入100ml硫酸钠溶液,振摇1分钟,静止分层后,弃去下层丙酮水溶液,留下石油醚提取液待净化。
十淀法测定化学试剂中的氯含量
一、 实验目的
1、 学习标准溶液的配置和标定方法
2、 掌握沉淀滴定法中以K2CrO4为指示剂,测定氯离子的方法原理
3、 学会正确判断滴定终点
二、 实验试剂
1、 AgNO3:固体
2、 K2CrO4指示剂:5%溶液
3、 NaCl:基准物质
三、 实验步骤
1、0.1mol/L的AgNO3溶液的配置和标定
1)配制:在台秤上称取8.5g AgNO3,溶于500mL无氯水中,将溶液转入棕色细口瓶中,置于暗处保存,以减缓因见光而分解的作用;
2)标定:准确称取1.5~1.6g的NaCl基准物质于100mL小烧杯中,加入50mL水溶解,定量转入250mL容量瓶中,加水稀释至刻度,摇匀。
准确移取25.00mL的NaCl标准溶液于250mL锥形瓶中,加25mL水,1mL质量分数为5%的K2CrO4指示剂,在不断摇动下用AgNO3溶液滴定至白色沉淀中出现砖红色并保持30s,即为终点。
根据NaCl的用量和滴定所消耗的AgNO3标准溶液体积,计算AgNO3标准溶液的浓度。
2、试样分析 准确称取粗食盐约2g,置于100mL烧杯中,加50mL水溶解,定量转入25mL容量瓶中,加水稀释至刻度,摇匀。
准确移取25.00mL试液于250mL锥形瓶中,加25mL水,1mL质量分数为5%的K2CrO4指示剂,在不断摇动下,用AgNO3溶液滴定至白色沉淀出现砖红色并保持30s,即为终点。平行测定三份,计算试样中氯的质量分数。