摘要:
本文介绍了分子伴侣的基本概念,以及分子伴侣的几种主要类型;简要说明了蛋白质折叠的概念及特点;在此基础上,进一步阐述了分子伴侣的功能,并以GroEL和GroES为例简述了分子伴侣在蛋白质折叠过程中的作用机理。最后介绍了分子伴侣概念的延伸,及其研究意义和展望。
关键词:
分子伴侣 蛋白质折叠 折叠病
20世纪60年代,人们就发现了由于组成蛋白质的氨基酸错误可以导致分子病,后来人们发现,即使一级结构正常,蛋白质的二级结构乃至立体结构异常也可导致疾病,即蛋白质折叠病,如疯牛病、老年性痴呆、囊性纤维性炎等[1]。蛋白质折叠病的发现激励人们去寻找蛋白质折叠的分子机理,近年来研究中发现,分子伴侣在在蛋白质折叠中起重要作用。
1分子伴侣简介
1.1分子伴侣的基本概念
分子伴侣(Molecular Chaperone),也有人翻译为“分子伴娘”。1978年,Laskey等首先用“分子伴侣”描述核质素(nucleoplasmin)在核小体组装过程中的作用[2]。1987年,Ellis将凡能促进蛋白质折叠和组装的蛋白质统称为分子伴侣[3]。随后,Ellis等又提出了分子伴侣的基本概念:在蛋白质折叠和组装过程中,分子伴侣防止多肽链内或链间因疏水键等相互作用表面瞬间暴露而形成错误结构,并且还可以破坏已经形成的错误结构。分子伴侣本身不是折叠或组装产物的一部分[4]。
1.2分子伴侣的几个例子
Nucleoplasmins:体内的一系列过程,如DNA复制,RNA转录与剪接,核小体或核糖体的装配,都涉及到带正电的蛋白质与带负电的核酸之间较强的离子键的相互作用。实验发现,这些过程都与Nucleoplasmin相类似的蛋白质的参与[5]。
Charperonin(Cpn):是指在细菌、线粒体、质体中发现的一类序列同源的Charperonins,该家族具有独特的双层7-9元环状结构的寡聚蛋白(Hemminngwen;cheng 1998),它们的作用是促进体内正常条件以及应急反应下的蛋白质折叠,这一过程需要ATP提供能量。Cpns包括细菌的GroEL、叶绿体的Rubisco亚基结合蛋白(RuSBP)与线粒体的热休克蛋白Hsp60[6]。
Stress-70家族:该家族首先在热休克反应中发现,并研究多年,近些年来,发现Stress-70也在蛋白质的折叠与装配过程中起作用,因而受到广泛关注。参与这些作用的Stress-70的成员有:E. coli的DnaK、酵母细胞质的Ssa1p和Ssa2p、内质网的Kar2p和线粒体的Ssc1p。哺乳动物细胞质的Hsp70蛋白和Prp73多肽识别蛋白、内质网的Bip。这些蛋白可被细胞内未折叠蛋白质的增多而诱导并识别靶分子,在其他热休克蛋白或细胞因子的参与下,水解ATP调节蛋白的构象或折叠状态[7]。
Stress-90家族:分子量在90ku左右,包括大肠杆菌胞浆中的HtpG、酵母胞浆中的Hsp83、哺乳动物胞浆中的Hsp90(Hsp83/Hsp87)与内质网中Grp94(ERp90或内质网素endoplasmin)[8]。它们可与脑浆中的类固醇激素受体结合,通过封闭受体的DNA结合域来阻碍其对基因转录调控区的激活作用,使转录调控区保持天然的非活性状态[9]。
其他类型的分子伴侣还有TRAP、大肠杆菌的SecB和触发因子及PapD、噬菌体编码的支架蛋白等,它们虽然不广泛存在于生物体中,但都各有其特点。
2 蛋白质折叠及其特点
蛋白质折叠的基础和核心就是一级结构决定高级结构,蛋白质的天然构象的形成是由它的多肽链上的氨基酸顺序决定的。体外实验表明,变性蛋白质的折叠是一个自发过程。但是进一步的实验表明这与蛋白质的体内折叠有明显不同。在体内,新生肽链的成熟实际上是在较高的温度,较高的蛋白浓度而又十分拥挤的环境中,以极快的速度和极高的保真度在进行着,简言之,以极高的效率进行着[10]。后续研究证明,体内蛋白质的折叠是需要帮助的,而分子伴侣则在这一过程中起重要作用。
近年来研究发现,变性蛋白或新生蛋白质的成熟,并不是一步形成的。体内蛋白质的折叠过程可用下图表示[10]:
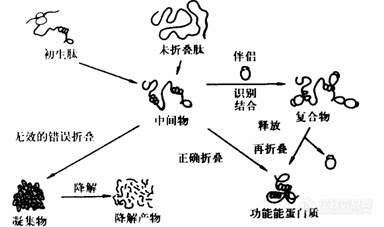
3分子伴侣在蛋白质折叠中的作用
3.1分子伴侣的功能
分子伴侣大概是生物体提高蛋白质合成效率的进化过程中产物。它们的功能是识别新生肽链折叠过程中形成的折叠中间物的非天然结构,如那些错误的疏水性表面。与折叠中间物形成复合物,防止它们之间过早或错误的相互作用而阻止不正确的无效的折叠途径,抑制不可逆的聚合物产生,从而提高蛋白质生物合成的效率,或变性蛋白质的复性效率 [10]。
3.2分子伴侣的作用机理
3.2.1Chaperonin与目的多肽链的作用
对Rubisco、β-内酰胺酶前体、硫氰酸酶(rhodanese)、二氢叶酸还原酶等的研究发现尽管这些蛋白质在大小,形状,功能和细胞区域来源上没有任何相似性,但它们的折叠过程都受Chaperonin的影响[11]。
许多证据表明,Chaperonin能专一的与变性或部分折叠的蛋白质结构结合,一旦蛋白质折叠成天然构象,便不再与Chaperonin结合。说明蛋白上存在有Chaperonin的结合位点,而天然蛋白质的形成,使这一结构特征消失。Chaperonin可以替代一些去垢剂促进硫氰酸酶的正确折叠,可以从某种程度上说明这一点[12]。GroEL可以与疏水性荧光指示剂bisANS结合也表明它的表面有疏水面的存在[12]。
3.2.2以伴侣蛋白GroEL和GroES 为例说明
X射线衍射结构测定证实,GroEL是由14个相同亚基组成的寡聚体,亚基分子量约为60kDa[13]。GroEL及GroEL-GroES复合物结构和功能如下图[14]:
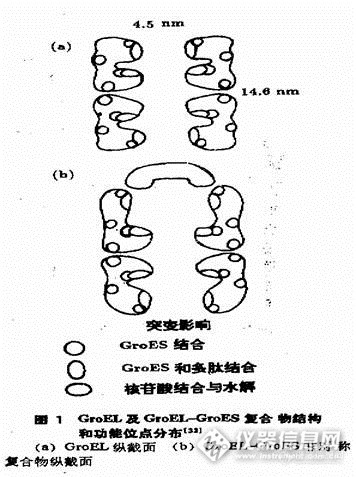
Hart1等和Lorimer等分别提出有关GroEL和GroES作用机理的模型[2,15,16]。在两个模型中,GroEL周期性的结合释放底物蛋白,每次释放,底物蛋白都发生折叠,二者相互作用至蛋白质形成天然构象,这时二者结合模序(motif)被掩埋,这一过程需要ATP的周期性结合与水解。
4分子伴侣概念的延伸
伴随着对分子伴侣研究的深入,分子伴侣的范围早已延伸而不再拘泥于最早的Ellis提出的定义。首先,分子伴侣不再局限于蛋白质,核糖体,RNA,甚至一些磷脂都被鉴定有分子伴侣的活性。其次,分子伴侣帮助的对象也不局限于蛋白质,还包括了其它生物大分子,如DNA,RNA等。再次,分子伴侣虽然不会在成熟的蛋白中发挥生物学作用的部分,但也可以共价的,暂时的结合在把蛋白上,而不必须分离[10]。
5结语
分子伴侣与蛋白质折叠有着非常重要的关系,对分子伴侣的研究不仅可以加深我们对生命现象的认识,并且具有重大的实用价值。构建分子伴侣在细胞内的共表达或融合表达可以帮助目的蛋白正确折叠,解决基因工程中外源基因表达产物不能正确折叠而在寄主细胞内形成包涵体的问题。对分子伴侣作用机理的研究必将有助于对蛋白质折叠病的了解和认识,伴随着对其研究的进一步深入,我们可以相信,将来,我们将有办法控制蛋白质折叠,并使折叠错误的蛋白恢复正常,攻克蛋白质折叠病这一医学难题!
参考文献:
[1] 巴德年 医学科学面对的新课题 中华医学杂志2002年1月10日第82卷第一期
[2]Todd MJ. Viitanen PV. Lorimer GH, 1994, Science, 265: 659-666
[3] Ellis RJ, 1987, Nature, 328: 378-379
[4]Ellis RJ. Van der vies SM. Hemmingsen SM, 1989, Biochem, Soc. Symp., 55:145-153
[5] Dingwall. C. et al.: EMBO J.6, 1881-1890, 1987
[6] Galenby. A.A.et al. Trends Biotech, 8: 354-358,1990
[7]Geibing. M.J. and Sambrook. J.: Nature 355:33-45,1992
[8]杨云慧等. 分子伴侣的研究进展 云南师范大学学报,2003,2
[9]陈德权等. 国外医学分子生物学分册,1995,17(4):145-149
[10]王志珍. 蛋白质折叠与分子伴侣 生物学通报,2004,39(5)
[11]陈小明. 杨胜利. 分子伴侣与蛋白质折叠 生物学通报,1993 ,13(1)
[12Mendoza. J.A. J. Biol. Chem. 266: 13044-13049, 1991
[13]Langer T, et al. 1992,BMBO J, 11:4757-4765
[14]郑东东,细胞生物学杂志,1996,18(2):68-73
[15]Martin J, et al. 1993, Nature, 366:288-233
[16]Hartl F-U, 1994, Nature, 371: 557-559



