1 引言
南瓜食品是世界上公认的特效保健食品。由于原料来源广泛便宜,生产投资少、见效快,市场前景广阔,具有巨大的经济效益。南瓜粉是一种高钙、高锌、高钾、低钠食品, 特别适合于中老年人、糖尿病和高血压患者食用[95]。南瓜粉防治糖尿病已被国内外所公认。研究证实,绝大部分Ⅱ型糖尿病患者服用南瓜粉后,可以使血糖降低,说明南瓜粉具有降血糖和升胰岛素的作用。南瓜防治糖尿病是在环丙基氨酸、果胶及几种微量元素和维生素等成分共同作用下实现的。因为南瓜粉是一种高钾低钠食品,而钾在人体内起着调节渗透与平衡的作用,高钾低钠饮食对预防心血管疾病、治疗浮肿有明显效果,所以南瓜粉适合于高血压和肾病患者食用。
采用酶法水解南瓜中的可溶性糖,可使其降解为寡糖。为了进一步增加产率,提高成本,酶固定化技术应用到了南瓜食品加工工业中。酶的固定化可回收及重复利用。因而固定化酶一般可以被认为是不溶性酶。与水溶性酶相比,固定化酶易于将固定化酶与底物、产物分开, 方便后续的分离和纯化;可以在较长时间内连续生产;酶的稳定性和最适温度提高, 最适pH值改变, 对温度和pH值适应范围增大, 对抑制剂和蛋白酶敏感性降低;酶反应条件容易控制;较水溶性酶更适合于多酶反应;可以增加产物的收率, 提高产物质量;酶的使用效率高,使用成本低;适于产业化、连续化、自动化生产。
本文采用3种不同的固定化酶法对α-淀粉酶和低聚糖酶进行固定化,选择最佳固定化方法。
2 材料与方法
2.1 主要材料
南瓜,市售日本南瓜;α-淀粉酶3700U/mL,北京奥博星生物技术有限责任公司;低聚糖酶20000CU/g,武汉鑫华远科技有限公司;海藻酸钠,AR,天津市光复精细化工研究所;3- 氨基丙基三乙氧基硅烷,AR,佛山市道宁化工有限公司。
2.2酶的固定化方法的选择
本试验首先选用3种固定化酶法,即海藻酸钠包埋法、共价交联法和大孔硅球吸附法对α- 淀粉酶进行固定,通过单因素试验得到了3种固定化方法的最佳方案和最大固定化率,之后选用最佳方法对低聚糖酶进行固定,并通过试验得到低聚糖酶的最佳固定条件。
2.2.1包埋法固定α- 淀粉酶的单因素试验
包埋法包埋固定化法是把酶定位于聚合物材料的格子结构或微胶囊结构中这样可以防止酶蛋白释放, 但是底物仍能渗人格子内与酶相接触。包埋材料主要有琼脂、琼脂糖、卡拉胶、海藻酸钠、聚丙烯酞胺、纤维素等。因为海藻酸钠具有无毒、安全、价格低廉、材料易得的特点,故本试验采用海藻酸钠作为包埋材料。
2.2.1.1 海藻酸钠的浓度的选择
分别配制浓度为3%、4%、5%、6%、7%的海藻酸钠溶液,使之在沸水浴中搅拌溶解,加入等体积酶含量为0.45 mg/mL的α-淀粉酶液,搅拌均匀。静置1 h后,滴入至2%的CaCl2溶液中,形成直径为5 mm左右的海藻酸钙凝胶珠,在4℃下静置固化1 h,取出用缓冲液过滤洗涤3次,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.1.2 固定化时间的选择
配制5份4 %海藻酸钠溶液,溶解后加入等体积的酶含量为0.45mg/mL α-淀粉酶液,搅拌均匀。静置1h后,滴入2% 的CaCl2溶液中,形成直径为5mm左右的海藻酸钙凝胶珠,在4℃下静置固化0.5 h、1 h、2 h、3 h、4 h,取出用缓冲液过滤洗涤3次,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.1.3 CaCl2溶液的浓度的选择
配制5份4%海藻酸钠溶液,溶解后加入等体积的酶含量为0.45mg/mLα-淀粉酶液,搅拌均匀。静置1h后,分别滴入至1%、2%、3%、4%、5%的CaCl2溶液中,形成直径为5mm左右的海藻酸钙凝胶珠,在4℃下静置固化1 h,取出用缓冲液过滤洗涤3次,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.1.4 α- 淀粉酶用量的选择
在4 %海藻酸钠溶液中,加入等体积的酶含量分别为0.15 mg/mL、0.30 mg/mL、0.45 mg/mL、0.60 mg/mL和0.75 mg/mL的α-淀粉酶液,搅拌均匀,静置1 h。滴入2% 的CaCl2溶液中,形成直径为5 mm左右的海藻酸钙凝胶珠,在4℃下静置固化1 h,取出用缓冲液过滤洗涤3次,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.2共价交联法固定α-淀粉酶的单因素试验
本试验采用了共价和交联相结合的方法。硅烷经水解生成硅醇,硅醇与硅球表面羟基(—OH)反应,得到硅烷化硅球。硅烷化硅球表面甲基(—CH3)与戊二醛中一个醛基(—CHO)发生键合反应,而戊二醛中另一个醛基则与酶的游离氨基(—NH2)反应,形成希夫碱(—N=C—)而使酶分子固定在硅球载体上。同时,戊二醛作为优良的固体化反应交联剂,在硅球表面与酶发生交联反应,使酶蛋白分子交联成网状覆盖在硅球表面[98]。
2.2.2.1 硅烷化回流时间的选择
取4个锥形瓶,向其中各加入1 g大孔硅球和5mL浓度为1%的3-氨基丙基三乙氧基硅烷的无水乙醇溶液,在80℃下分别回流1 h、5 h、10 h和15 h;后冷却、抽滤,用无水乙醇洗涤3次,真空干燥,得到氨丙基大孔硅球。经10 mL 2%戊二醛活化3 h后,用pH值为6.0 的磷酸氢二钠-柠檬酸缓冲溶液充分洗涤至洗涤液中无戊二醛后真空干燥。向活化好的硅球中加入10 mL酶含量为1.5 mg/mL的α-淀粉酶液,在15℃下振荡9 h后,取出后pH =6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.2.2 APTES的用量的选择
向4个已加入1 g大孔硅球的锥形瓶中,分别倒入5mL浓度为0.5%、1%、7%和10%的3-氨基丙基三乙氧基硅烷的无水乙醇溶液,在80℃下回流5 h;后冷却、抽滤,用无水乙醇洗涤3次,真空干燥,得到氨丙基大孔硅球。经10mL 2%戊二醛活化3 h后,用pH 值为6.0 的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤至洗涤液中无戊二醛后真空干燥。向活化好的硅球中加入10mL 酶含量为1.5mg/mL的α-淀粉酶液,在15℃下振荡9 h。取出后pH =6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.2.3 戊二醛浓度的选择
取4g大孔硅球 ,放入盛有20 mL浓度为1%的3- 氨基丙基三乙氧基硅烷的无水乙醇溶液中80℃回流5 h;后冷却、抽滤,用无水乙醇洗涤3次,真空干燥,得到氨丙基大孔硅球。将硅球分成4份,分别加入10 mL浓度为1%、2%、3%和4%的戊二醛活化3 h后,用pH 值为6.0 的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤至洗涤液中无戊二醛后真空干燥。将活化好的硅球加入10 mL酶含量为1.5 mg/mL的α-淀粉酶液,在15℃下振荡9 h后取出,用pH =6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.2.4 固定化酶时间的选择
称取5 g大孔硅球 ,放入盛有25 mL浓度为1%的3- 氨基丙基三乙氧基硅烷的无水乙醇溶液中80℃回流5 h;后冷却、抽滤,用无水乙醇洗涤3次,真空干燥,得到氨丙基大孔硅球。经50 mL 2%戊二醛活化3 h后,用pH 为6.0 的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤至洗涤液中无戊二醛后真空干燥。将活化好的硅球分成5份,每份都加入10mL 酶含量为1.5mg/mL的α-淀粉酶液,在15℃下分别振荡3 h、5 h、7 h、9 h和11 h。取出后pH =6.0的磷酸氢二钠-柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.2.5 固定化酶温度的选择
称取4 g大孔硅球 ,放入盛有20 mL浓度为1%的3- 氨基丙基三乙氧基硅烷的无水乙醇溶液中80℃回流5h;后冷却、抽滤,用无水乙醇洗涤3次,真空干燥,得到氨丙基大孔硅球。经40 mL 2%戊二醛活化3h后,用pH 值为6.0 的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤至洗涤液中无戊二醛后真空干燥。将活化好的硅球分成4份,每份都加入10 mL酶含量为1.5mg/mL的α-淀粉酶液,分别在4℃、10℃、15℃和25℃下振荡9 h后,取出后pH =6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.2.6 α- 淀粉酶给酶量的选择
称取4 g大孔硅球 ,放入盛有20 mL浓度为1%的3- 氨基丙基三乙氧基硅烷的无水乙醇溶液中80℃回流5 h;后冷却、抽滤,用无水乙醇洗涤3次,真空干燥,得到氨丙基大孔硅球。经40mL 2%戊二醛活化3 h后,用pH 值为6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤至洗涤液中无戊二醛后真空干燥。将活化好的硅球分成5份,向其中加入10mL酶含量分别为0.75mg/mL、1.5 mg/mL、3 mg/mL和6 mg/mL的α-淀粉酶液,在15℃下分别振荡9 h。取出后pH =6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.3吸附法固定α-淀粉酶的单因素试验
吸附固定是最简单的方法, 酶与载体之间的亲和力是范德华力、离子键和氢键。物理吸附法使用对蛋白质具有高度吸附能力的非水溶性载体,如活性碳、几丁质、多孔玻璃、大孔硅球等作为吸附剂,将酶吸附到表面上使酶固定化。这种方法操作简单,反应条件温和,物质传质速率大,载体可反复使用。本试验采用大孔硅球(80-100目)作为固定载体。
2.2.3.1 固定化温度的选择
取5只锥形瓶,各称取1 g大孔硅球和加入10mL 酶含量为4.5 mg/mL的α-淀粉酶液,在pH值为6.0时进行振荡吸附7h,温度分别为4℃、10℃、15℃、25℃、35℃。后用pH 值为6.0 的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.3.2 pH值的选择
取5只锥形瓶,各称取1 g大孔硅球和加入10 mL酶含量为4.5 mg/mL的α-淀粉酶液,在15℃下时进行振荡吸附7 h,pH值分别为4.0、5.0、6.0、7.0和8.0。后用相应pH值的磷酸氢二钠-柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.3.3 固定化时间的选择
取5只锥形瓶,各称取1 g大孔硅球和加入10 mL酶含量为4.5 mg/mL的α-淀粉酶液,在15℃、pH值为6.0的条件下时分别振荡吸附3h、5 h、7 h、9 h和11 h。后用pH值为6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
2.2.3.4 给酶量的选择
在5只锥形瓶中各称取1 g大孔硅球,后分别加入10 mL酶含量为1.5 mg/mL、3mg/mL、4.5 mg/mL、6 mg/mL和7.5 mg/mL的α- 淀粉酶液,在15℃、pH值为6.0的条件下时分别振荡吸附7h。后用pH 值为6.0的磷酸氢二钠- 柠檬酸缓冲溶液充分洗涤,真空干燥,即得固定化酶。测固定化酶的活性确定最佳反应条件。
3 结果与讨论
本试验先对3种固定化酶法,即海藻酸钠包埋法、共价交联法和大孔硅球吸附法进行单因素试验,根据固定化酶活力选择最佳方法。
3.1包埋法固定α- 淀粉酶的优化
3.1.1海藻酸钠的浓度对固定化酶活力的影响
海藻酸钠具有强烈的吸附作用,可以与钙、铜等正二价阳离子迅速形成凝胶,其作为固定化酶的载体,对固定化酶的酶活有显著的影响。
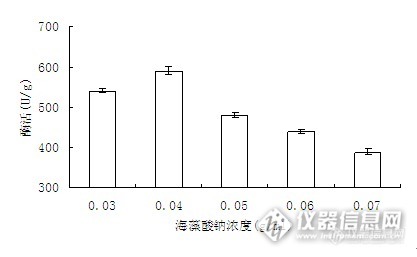
图1 海藻酸钠的浓度对固定化酶活力的影响
由图1知,海藻酸钠浓度为4%时,酶活达到了最大值,且具有很好的成形性。海藻酸钠浓度小于4%时,胶粒不易成形,且凝胶的孔径大,固定化酶容易流失,所以酶活较低。海藻酸钠的浓度在4%以上时,则会导致混合液过于粘稠。虽然随着海藻酸钠添加量的提高,被固定化的蛋白质量有所增加,但当海藻酸钠添加量大于4%时,一方面将导致酶珠过于致密,凝胶的孔径变小,降低物质传递速率,降低酶与底物接触的速度;另一方面,4 %以上的海藻酸钠添加量将增加酶液成形的难度。因此最终选择浓度为4%的海藻酸钠用于固定化。
3.1.2固定化时间对固定化酶活力的影响
Ca2+的架桥作用是一个逐步进行的过程,当混合液滴入固定液中时,Ca2+最先与混合液的外部接触,置换最外部的Na+,并逐步向内扩散。因此,存在一个合适的固定化时间,使得混合液中的Na+全部被置换,内部的酶蛋白全部被固定。
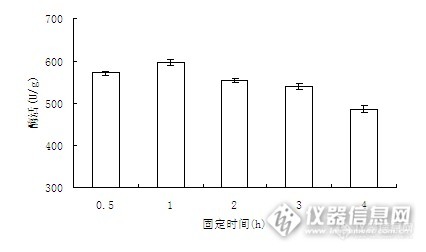
图2 固定化时间对固定化酶活力的影响
由图2可以看出,开始固定化时,由于包埋逐渐紧密,流失减少,固定化酶的活性呈升高趋势。固定1 h时,酶活达到最大。超过1h,酶活开始降低,这是由于成形的酶珠过于致密且钙离子会与酶作用,导致酶活降低。
3.1.3 CaCl2溶液的浓度对固定化酶活力的影响
海藻酸钠包埋法的主要原理是基于Ca2 +的架桥作用使海藻酸钠形成空间网格状结构,酶得以固定在其中。CaCl2的浓度与海藻酸钠形成空间网格状结构的致密程度有关,而网格密致程度会对固定化酶活力造成影响,所以要确定CaCl2溶液的最佳浓度。
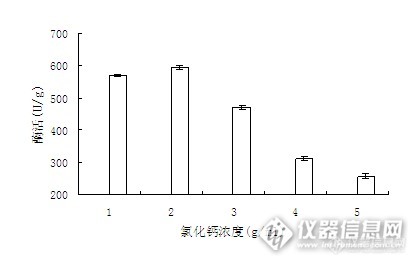
图3 CaCl2溶液的浓度对固定化酶活力的影响
由图3可知,CaCl2溶液的最适浓度为2%。CaCl2的浓度太低会导致凝胶强度太小,包埋不完全,包埋在内部的部分酶会流失;而CaCl2过高浓度一方面加大了空间网格状结构对酶的挤压,导致酶的空间结构发生改变,降低酶的活性;另一方面,高分子联结较紧密,会使底物的向内扩散和产物的向外扩散变得更加困难,导致底物缺乏和产物抑制,表观酶活降低。
3.1.4 α- 淀粉酶用量对固定化酶活力的影响
给酶量直接关系到固定化酶的活力。
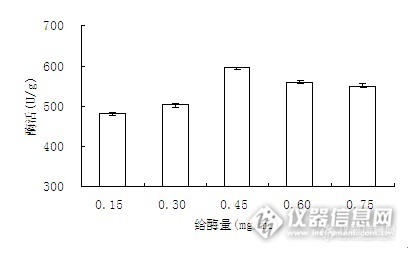
图4 α- 淀粉酶用量对固定化酶活力的影响
由图4可知,随着给酶量的增加,固定化酶的活力逐步增加,酶含量达到0.45mg/ml时酶活最大。当酶含量超过0.45 mg/ml之后,酶活随着酶用量的增大而减小。这是由于一定量载体其结合容量是固定的,随给酶量的增加其活性虽也不断增大,但当达到饱和载量后,过多结合的酶使空间位阻增加、扩散限制增大,底物和酶、产物不能充分接触与转移,从而影响酶活力,同时过多的结合酶也易使酶活性中心改变影响酶活力。
综上所述,海藻酸钠包埋法固定α-淀粉酶的最佳条件为:海藻酸钠的浓度为4%,CaCl2的浓度为2%,固定化时间为1 h,α-淀粉酶的给酶量为0.45 mg/ml。在此条件下所得的最大酶活力回收率为18.36%。
3.2共价交联法固定α- 淀粉酶的优化
3.2.1硅烷化回流时间对固定化酶活力的影响
回流时间会影响多孔玻璃表面生成烷基胺玻璃的程度,玻璃表面被烷基胺玻璃完全覆盖是最理想的状态。
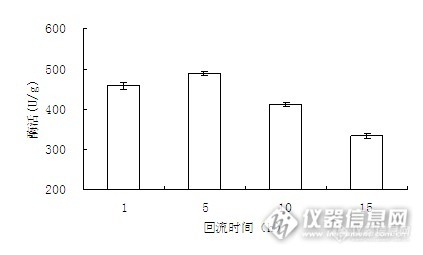
图5 硅烷化回流时间对固定化酶活力的影响
由图5可知,当回流时间小于5h时,酶活随回流时间的增大而增大。在回流时间为5 h时,酶活达到最大。之后酶活随回流时间的增大而逐渐减小。在小于5 h时,酶活随着硅烷偶联剂的增多而增大。当回流时间为5 h时,硅烷偶联剂达到饱和,此时的酶活最大。之后,硅醇之间的缩合反应将会上升到主导地位,使硅烷偶联剂的作用降低,导致固定化率下降。
3.2.2 APTES的用量对固定化酶活力的影响
APTES改善生物活性玻璃与有机相的界面相容性,因为它的氨丙基可以对有机相中的羧基具有反应活性,能够牢固的结合有机相,提高复合支架的力学性能。
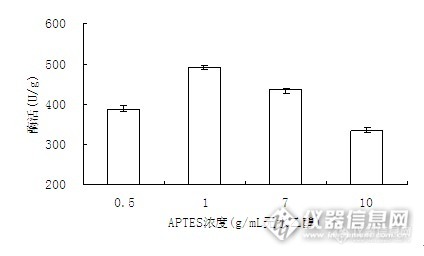
图6 APTES的用量对固定化酶活力的影响
由图6知,当APTES浓度小于1%时,酶活随着其浓度的增加而增加;当浓度在1%时,酶活最大。其后,酶活随APTES浓度的增多而减少。这是当APTES的浓度小于1%时,APTES浓度的增加可促进水解生成的硅醇与载体表面的羟基键合,故酶活又开始随其浓度的增加而增加。但其浓度超过1%,硅醇之间的缩合反应将会上升到主要地位,此时硅烷偶联剂偶联作用的大小按单体、二聚体、三聚体、……、高聚物的顺序迅速降低,甚至失去作用。
3.2.3戊二醛浓度固定化酶活力的影响
戊二醛是一种固定化效率高而低毒的偶联剂, 先与3-氨基丙基三乙氧基硅烷反应得到活化载体,再与α-淀粉酶的分子中的-NH2反应,形成希夫碱(—N=C—)而使酶分子交联,从而将酶固定在载体上。

图7 戊二醛浓度固定化酶活力的影响
由图7可知,当加入浓度为2%的戊二醛时,酶活最大。这是由于在低浓度时,,导致酶的交联不够充分,影响固定化酶活力回收率和固定化酶的稳定性。但戊二醛同时又是酶的抑制剂,当浓度超过一定范围时,其抑制作用占到主要方面,导致酶构象改变而失活,此外,还会造成固定化酶与戊二醛发生二次交联,降低固定化酶的活力。
3.2.4固定化酶时间对固定化酶活力的影响
固定化时间会影响戊二醛与α-淀粉酶的分子中的-NH2反应。
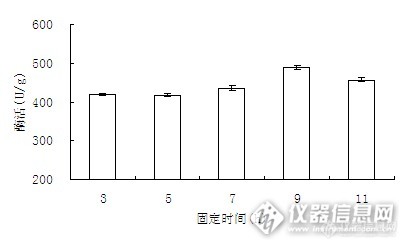
图8 固定化酶时间对固定化酶活力的影响
由图8可以看出,固定化酶活力随固定化时间的延长而增大,在9 h达到最大值,而后有所下降。这可能是由于随着反应时间的增加,载体的载酶量增大,酶本身相对集中致使空间位组增大,影响了酶和底物的有效接触,以及产物向溶液中的扩散,使固定化酶的活力下降。
3.2.5固定化酶温度对固定化酶活力的影响
酶是蛋白质,温度过高会使其变性,活性降低;温度过低会使偶联速度变慢,单位时间偶联的酶少,酶的活性也可能降低,因此存在最佳固定温度。
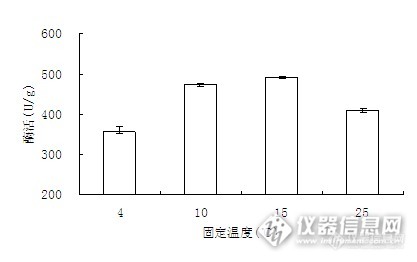
图9 固定化酶温度对固定化酶活力的影响
由图9可以看出,硅烷化大孔硅球的最佳固定温度为15℃。且在10℃以下及15℃以上的区域固定化酶活力下降迅速,在10℃-15℃的区域随温度升高,相对活力逐渐增大,但增速较慢。
3.2.6给酶量对固定化酶活力的影响
保证其它反应条件不变,改变给酶量,得到共价交联法固定α- 淀粉酶的最佳给酶量。
由图10可知,酶含量为1.5 mg/ml时,活力最高。随着给酶量的进一步加大,所得的固定化酶的活力下降。这是由于给酶量太少,多孔表面偶联不饱和,固定化酶活性底;给酶量太多,固定化后酶密度太高亦不利于酶活性的发挥,另一方面可能会增大微孔的位阻。

图10 给酶量对固定化酶活力的影响
综上所述,共价交联法固定α- 淀粉酶的最佳条件为:硅烷化回流时间为5 h,APTES用量为1g/mL无水乙醇,戊二醛浓度为0.02 g/mL,固定化时间为9 h,固定化温度为15℃,α-淀粉酶的给酶量为1.5 mg/mL。此条件下得到的固定化酶的最大酶活力回收率为15.21%。
3.3吸附法固定α- 淀粉酶的优化
3.3.1固定化温度对固定化酶活力的影响
保证反应pH值、固定化时间和给酶量不变,改变固定化温度,得到吸附法固定α- 淀粉酶的最佳固定化温度。
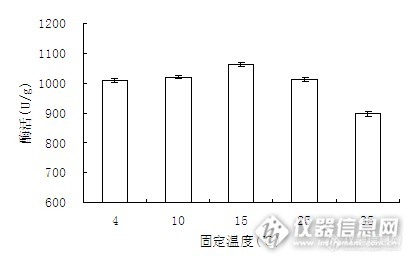
图11 固定化温度对固定化酶活力的影响
由图11可知,随着固定温度的升高,固定化酶的酶活呈现上升趋势,当温度为15℃时,酶活最高。当温度超过15℃后,酶活随着温度的上升而减小。这是由于固定温度低于15℃时,酶与载体之间的吸附不充分,而高于15℃时,游离酶在反应过程中可能会失去活性。因此,温度偏高或偏低都会导致固定化酶的活力下降。
3.3.2 pH值对固定化酶活力的影响
pH可以使酶表面上的特性基团发生电离作用,强酸性条件下的-NH2会变为-NH3+,强碱性条件下-COOH会变为-COO-,在某一pH范围内-NH3+和-COO-同时存在,成为两性离子,这种两性离子是酶保持活性的关键。因此,固定时要研究pH对固定的影响。
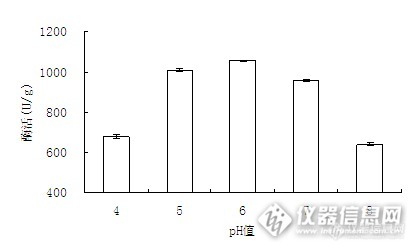
图12 pH值对固定化酶活力的影响
Fig.3-12 The effect of pH on immobilized enzymeactivity
由图12可知,随着pH值的增大,固定化酶的酶活呈现上升趋势,当pH值达到6.0时,酶活最高。当pH值超过6.0后,酶活随着pH值增大而减小。这是因为pH过高会影响酶的活性,同时pH过低会减少酶分子和载体的亲和吸附作用。
3.3.3固定化时间对固定化酶活力的影响
保证反应pH值、固定化温度和给酶量不变,改变固定化时间,得到吸附法固定α- 淀粉酶的最佳固定化时间。
由图13知,随着固定化时间增加,固定化酶的酶活呈现上升趋势,当固定化时间达到7 h时,酶活最高。当固定化时间超过7h后,酶活随着时间延长而减小。时间过短,则吸附未达到饱和,酶活力随时间的增加而增大;吸附7 h酶达到饱和后,吸附过多的酶会使底物和酶、产物不能充分接触反应,从而影响酶活力。
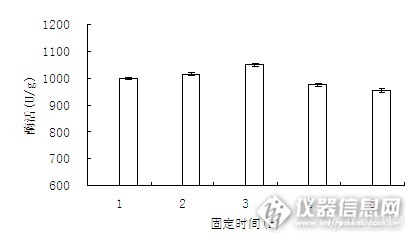
图13 固定化时间对固定化酶活力的影响
3.3.4给酶量对固定化酶活力的影响
保证反应pH值、固定化温度和固定化时间不变,改变给酶量,得到吸附法固定α- 淀粉酶的最佳给酶量。

图14 给酶量对固定化酶活力的影响
由图14可知,当酶含量为4.5 mg/ml时,固定化酶活力最高。此时,酶的吸附量达到饱和。多于或少于此量,都会使固定化酶的活力降低。这是因为固定化载体可吸附的酶量是有限的。在载体量一定的条件下,当酶量相对较多时,载体所吸附的酶蛋白也较多。但由于每个载体分子表面吸附的酶蛋白量相对过多,从而造成酶分子相互聚集成团,酶分子的活性中心有可能被遮盖,尽管大孔硅球吸附的蛋白量很多,但酶的催化活性仍很低;反之,当酶量相对较少时,载体吸附的酶蛋白也较少,载体分子表面并没有吸附足够的酶蛋白,使载体并没有被完全利用,因此酶的活性也很低。
综上所述,大孔硅球吸附法固定α-淀粉酶的最佳条件为:固定化时间为7 h,固定化温度为15℃,pH值为6.0,α-淀粉酶的给酶量为4.5mg/mL。此条件下得到的固定化酶的最大酶活力回收率为32.75%。
4 结论
试验首先确定了固定化酶的方法及α- 淀粉酶和低聚糖酶的固定化条件。固定化酶方法的确定是根据海藻酸钠包埋法、共价交联法和大孔硅球吸附法对α- 淀粉酶的最大固定化率决定的。通过对以上3种固定化酶的方法做单因素试验可知:海藻酸钠包埋法的最大酶活力回收率为18.36%;共价交联法的最大酶活力回收率为15.21%;大孔硅球吸附法的最大酶活力回收率为32.75%。















