奥美拉唑成品中杂质的质量检测
摘要:目的:在对奥美拉唑原料药中引入的基因毒性杂质,即4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺设定质量检测方法,并进行方法验证。同时,对合成工艺中引入的残留溶剂进行质量检测,确保奥美拉唑成品的质量安全。方法:在对4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行质量检测中,采用液相色谱的方法,并对其进行限度验证;而对残留溶剂采用气相色谱,利用内标法进行质量检测。结果:本研究对两种基因毒性杂质及残留溶剂的检测是可行有效的,有利于对奥美拉唑原料药的质量监控,同时为后续对奥美拉唑质量标准的制定提供理论依据。
关键词:奥美拉唑;质量标准;毒性杂质;残留溶剂
Abstract Objective: Themass detection is set in the introduction of genotoxic impurities into theomeprazole APIproducts, namely 4-methoxy-2-nitroaniline and4-methoxy-o-phenylenediamine, and the method was verified.At the same time, the quality of theresidual solvent introduced in the synthesis process is checked to ensure thequality and safety of the omeprazole.Methods:In the mass detection of4-methoxy-2-nitroaniline and 4-methoxy-o-phenylenediamine, the method of liquidchromatography is used, and the limit is verified; the residual solvent aretested by the gas chromatogram and internal standard method for quality.Results:This study is feasible and effective for the detection of twogenotoxic impurities and residual solvents, which is the benefit of qualitymonitoring of omeprazole APIproducts, and provides a theoretical basis forthe subsequent development of omeprazole quality standards.
Keywords: Omeprazole; Quality standard; Genotoxicimpurities; Residual solvents
随着人们平时工作、学习等压力的不断增加,导致消化类疾病患病率不断上升,而在中国,发病率已达到20%左右。用于治疗消化类疾病的药物也逐步成为生活中的常用药,其发展市场也在不断扩大。在消化系统溃疡类疾病的临床治疗中,质子泵抑制剂类药物因其具有良好的治疗效果,市场销售份额高达58%。而奥美拉唑是质子泵抑制剂类的代表药物,通过抑制胃酸分泌,用于治疗胃溃疡、十二指肠溃疡等疾病。但长期服用奥美拉唑存在着潜在风险,可能会引起心脏类疾病等。且其生产过程引入的有机杂质、基因毒性杂质、无机杂质或残留的有机溶剂等均对人体健康有一定危害。因此,建立奥美拉唑引入杂质或残留有机溶剂的质量检测方法是十分有必要的,严格控制质量标准,把控药品市场质量安全。
1 仪器与材料
1.1 实验仪器
高效液相色谱仪(THERMO SCIENYIFIC, Mltimate3000);电子天平(METTLER-TOLEDO、BP-210S) 气相色谱仪(Agilent 6890N)顶空进样器(Agilent 7694E)
1.2 实验试剂
表1-1 实验所需试剂
| 实验试剂 | 厂家 |
| 磷酸二氢钾 | 莱阳经济技术开发区精细化工厂 |
| 氢氧化钾 | 国药集团 |
| 乙腈 | Fisher Scientific |
| 4-甲氧基-2-硝基苯胺 | 北京百灵威科技有限公司 |
| 4-甲氧基-邻苯二胺 | Alfa Aesar |
| 奥美拉唑 | 寿光富康制药有限公司 |
| 分析纯 | 丙酮 | 西陇化工股份有限公司 |
| 甲醇 | Fisher Scientific |
| 苯 | 天津富宇化工有限公司 |
| 甲苯 | 莱阳经济技术开发区精细化工厂 |
| 二氯甲烷 | 天津科密欧化学试剂有限公司 |
| DMA | Sigma-Aldrich |
2 基因毒性杂质的检验方法的设定及方法学验证
来源于起始物料苯并咪唑的合成路线的基因毒性杂质不适用于药典各论方法检测此类物质,在药典规定的波长无吸收。因此,采用液相色谱方法,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测和控制。
2.1色谱条件
色谱柱:ODS-3,5μm,4.6×250mm;检测波长分别设定为4-甲氧基-2-硝基苯胺(230nm)及4-甲氧基-邻苯二胺(210nm);流速为1.0ml/min;进样量为80μl;柱温为30℃。
2.2 溶液配制
1) 流动相:溶解6.8g的磷酸二氢钾用纯化水溶解并稀释至1000ml,用氢氧化钾调节pH至6.5,和乙腈按(73:27)混合。
2) 对照溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再量取1ml用流动相稀释至50ml。
3) 奥美拉唑供试液:称取奥美拉唑样品100mg,精密称定置于50ml容量瓶中,用流动相溶解并稀释至刻度。
注:计算奥美拉唑中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺含量都不得超过8ppm。
2.3质量检测方法验证
通过限度验证,即该方法的专属性、系统适应性、检测限以及样品测定,是否符合验证可接受的标准,来判断该方法是否符合标准,可用于杂质测定。
2.3.1 专属性
1) 溶液配制
定性溶液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用配制完毕的流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml,再稀释1ml用流动相稀释至50ml。
2) 测定
取流动相作为空白、定性溶液进样,记录色谱图,数据和结果。
3) 数据与结果
表2-1专属性测试数据和结果
| 项目 | 4-甲氧基-2-硝基苯胺峰面积(230nm) | 4-甲氧基-邻苯二胺峰面积(210nm) |
| 空白 溶液 | 未检出 | 未检出 |
| 定性 溶液 | 8550 | 12258 |
表2-2信噪比测试数据和结果
| 杂质 | 信噪比 |
| 4-甲氧基-2-硝基苯胺峰面积(230nm) | 0 |
| 4-甲氧基-邻苯二胺峰面积(210nm) | 0 |
2.3.2系统适用性试验
1) 溶液制备
贮备液:取4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺各16mg,精密称定置于200ml容量瓶中,用流动相溶解并稀释至刻度,准确量取1ml此溶液用流动相稀释至100ml。
杂质溶液:用流动相稀释1ml贮备液到50ml或用专属性定性溶液及图谱。
分离度:称取埃索美拉唑镁或奥美拉唑镁样品100mg,精密称定置于50ml容量瓶中,用流动相溶解后准确加入1ml贮备液并用流动相稀释至刻度。
2) 测定
以方法规定的色谱条件,取杂质溶液、分离度溶液分别进样,记录色谱图,数据和结果。
3) 数据与结果
表2-3 系统适用性性测试结果
| 溶液 名称 | 峰面积1 | 峰面积2 | 峰面积3 | 峰面积4 | 峰面积5 | 峰面积6 | 峰面积平均值 | RSD |
| 4-甲氧基-2-硝基苯胺峰面积(230nm) | 8427 | 8425 | 8481 | 8533 | 8483 | 8460 | 8468.17 | 0.48% |
| 4-甲氧基-邻苯二胺峰面积(210nm) | 11701 | 11539 | 11086 | 11043 | 10548 | 10679 | 11099.33 | 4.11% |
表2-4 奥美拉唑和4-甲氧基-邻苯二胺分离度测试结果
| 名称 | 保留时间 | 分离度 |
| 相邻杂质峰 | 3.813 | - |
| 4-甲氧基-邻苯二胺峰面积(210nm) | 4.736 | 2.16 |
| 相邻杂质峰 | 5.248 | 1.69 |
表 2-5奥美拉唑和4-甲氧基-2-硝基苯胺分离度测试结果
| 名称 | 保留时间 | 分离度 |
| 相邻杂质峰 | 23.168 | - |
| 4-甲氧基-2-硝基苯胺峰面积(230nm) | 26.908 | 3.32 |
| 相邻杂质峰 | 29.467 | 2.85 |
2.3.3检测限
1) 溶液制备
按照选择项下贮备溶液的配制方法配制溶液,并将标准溶液逐步稀释,得到适当浓度的溶液。
2) 测定
在色谱条件下,取溶液进样,记录色谱图。当待测组分的信噪比大于2时,对应的浓度为该组分的最小检测浓度。
3) 数据与结果
4-甲氧基-2-硝基苯胺检测限0.00256 μg/ml,LOD=1.28ppm,S/N=2.22;
4-甲氧基-邻苯二胺检测限0.00256μg/ml,LOD=0.000128,S/N=2.
2.3.4样品检测
1) 溶液配制
根据已设定检测方法已将溶液配制完毕。
2) 测定
分别取三批样品按照溶液的配制方法,配制供试液进样,记录色谱图。
3) 数据与结果
表2-6 奥美拉唑样品检测结果
| 批号 | 4-甲氧基-2-硝基苯胺(230nm) | 4-甲氧基-邻苯二胺(210nm) |
| 20150401 | 未检出 | 未检出 |
| 20150402 | 未检出 | 未检出 |
| 20150403 | 未检出 | 未检出 |
3残留溶剂的检测方法的设定
在《中国药典》规定的奥美拉唑中各论残留溶剂的检测方法的基础上,进行修正,更改部分参数,选用内标法对残留溶剂进行检测,有利于快速检验及产品及时入库。
3.1 色谱条件
1) 气相部分
色谱柱:Agilent DB-624, 0.32mm×30m,膜厚1.8μm;柱温先以50 ℃保持5分钟,后以20℃/min升温到200℃保持4分钟;进样口温度为200℃; 分流比为1:1;检测器为FID,其温度为300℃;载气设定为氮气;柱流量则为3.0ml/min。
2) 顶空部分
顶空瓶平衡温度98℃,平衡时间20min;定量环温度115℃,体积1ml;传输管线温度为130℃。
3.2 溶液配制
1) 苯贮备液:精密称取苯0.02g于已加入少量DMA的100ml容量瓶中,用DMA稀释至刻度,摇匀。
2) 标准贮备液:精密称取丙酮0.15g,甲醇0.1g,二氯甲烷0.01g,甲苯0.03g,于已加入少量DMA的100ml容量瓶中,在此容量瓶中加入1ml准确量取的苯贮备液,用DMA稀释至刻度,摇匀。
3) 标准溶液:精密量取标准溶液贮备液5.0ml于50 ml容量瓶中,用DMA稀释至刻度,混合均匀。
4) 供试溶液:精密称定样品0.5g于20ml顶空瓶中,用5ml DMA溶解。
3.3 检测方法
1) 按照气相部分和顶空部分的操作条件设定操作方法。取标准溶液顶空进样,记录色谱图(主要组分出峰顺序依次为甲醇、丙酮、二氯甲烷、苯、甲苯)。
注:计算相邻组分之间的分离度R,均应不小于1.5;取6份标准溶液,连续进样,计算各溶剂峰面积的RSD,应不大于10%。
2) 先将空白溶液、6份标准溶液和样品溶液各5ml置于顶空瓶中,密封。取空白溶液进样,记录图谱,再取6份标准溶液,记录色谱图,进行系统适用性试验和标准校正,最后取供试溶液进样,记录图谱。
计算公式如下式(2-1):
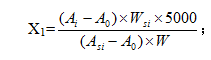 ;
;
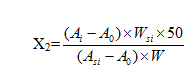
注:
X1:残留甲醇、甲苯、二氯甲烷、丙酮的量,ppm;
X2:残留苯的量,ppm;
Ai:供试溶液的图谱中溶剂(i)的峰面积;
A0:空白溶液的图谱中溶剂(i)的峰面积;
Asi:标准溶液的图谱中溶剂(i)的峰面积;
W:样品的称量,g;
Wsi:溶剂(i)的称重,g。
3.4 检测结果
表3-1 奥美拉唑残留溶剂检验结果
| 项目 | 标准 | 方法 | 奥美拉唑检验批号 |
| A-51511507002 | A-51511507003 | A-51511507004 |
| 残留溶剂检验 | 丙酮不得超过1500ppm | 内控 | 309ppm | 396ppm | 423ppm |
| 二氯甲烷不得超过100ppm | 未检出 | 未检出 | 未检出 |
| 甲醇不得超过500ppm | 115ppm | 129ppm | 122ppm |
| 甲苯不得超过300ppm | 未检出 | 未检出 | 未检出 |
| 苯不得超过1ppm(LOQ) | 未检出 | 未检出 | 未检出 |
4小结
本研究对治疗胃溃疡的一线药物奥美拉唑进行质量检验方法的研究。通过分析其合成过程中引入的杂质,创新性的提出原料药中可能存在的基因毒性杂质4-甲氧基-2-硝基苯胺、4-甲氧基-邻苯二胺,同时对生产过程引入的残留有机溶剂进行质量监控。根据ICH的指南Q2A和Q2B的要求,采用液相色谱,对奥美拉唑成品中的4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺进行限度检测,并对检测方法进行了专属性、系统适应性、检测限,样品测定等方面的限度验证。限度验证结果均应符合标准,说明该检测方法符合测定的准确性、可靠性和灵敏度的要求,能够进行该杂质的测定。且使用该方法进行三种批号的奥美拉唑基因毒性杂质检验时,均未发现存在4-甲氧基-2-硝基苯胺和4-甲氧基-邻苯二胺。说明现有的工艺可有效除去原料药中引入的这两种基因毒性杂质,可不放入日常质量监控之中。
同时,在对奥美拉唑合成工艺中残留的有机溶剂的质量检测研究中,进行检测时,发现,其药品中检测出少量的丙酮和甲醇,但均在质量标准规定以内,未检测出二氯甲烷、甲苯、苯,说明选用的三批奥美拉唑成品药均符合药品质量标准。而在检测中,本研究创新性使用不同于中华人民共和国药典中的N ,N-二甲基甲酰胺(DMF),而选择易于冲洗的N ,N-二甲基乙酰胺(DMA)做溶媒,易冲洗干净,且不影响公司内其它产品的检测,与中华人民共和国药典方法相比,大大缩短检验样品的时间,中华人民共和国药典方法单个样品的检测时间为65min,内控的方法仅为36.5min,对工业化规模生产来说,快速检测样品既经济又能保证产品及时入库。
参考文献
AnaLuisa Correia, Mina J Bissell. The tumor microenvironment is a dominantforceinmulti drμg resistance.Drμg Resist Update. 2012, 15(6):39-49.
Shaojun Shi, ΜlrichKlotz,Protonpump inhibitors: an update of their clinical us and pharmacokinetics .EurJ Clin Pharmacol, 2008, 64(30): 935-951.
ICHVALIDATION OF ANALYTICAL PROCEDURES: TEXT AND METHODOLOGY Q2 (R1) Current Step4 version (Complementary Guideline on Methodology dated 6 November 1996incorporated in November 2005).
国家药典委员会.中华人民共和国药典.二部.北京:中国医药科技出版社, 2015: 1412.


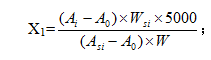 ;
;