NIR用于不同NaCl浓度下HSA与IgG结构变化的研究
蛋白质的分子内及分子间存在氢键相互作用、离子键相互作用以及分子的疏水作用力等,溶解于不同的介质溶液中,蛋白质的溶解性及其结构不同。在蛋白质的提取分离纯化等过程中,多数蛋白质水溶液中含有NaCl,在蛋白质水溶液中,由于蛋白质颗粒表面多为亲水基团,NaCl溶解在水中会导致水的结构发生改变,从而导致蛋白质结构发生改变,在近红外光谱上会有所体现。
本章讨论不同浓度NaCl对蛋白质结构的影响,原因可能是由于水溶液中NaCl浓度的变化导致离子强度不同从而产生影响;Na+在水溶液中与水分子形成络合物,进而导致蛋白质结构的改变。利用近红外光谱分析技术探究蛋白质在不同浓度的NaCl水溶液中所发生的结构变化,为蛋白质的提取、分离、纯化等工艺过程提供更有利的条件。
3.1 实验仪器与试剂
3.1.1实验仪器与软件
表3-1 实验仪器与软件
| 仪器/软件 | 规格与型号 | 生产厂家 |
| 电子分析天平 | ME54E | 梅特勒-托利多仪器股份有限公司 |
| 移液枪 | 1000μL、100μL | 美国Thermo Fisher公司 |
| 傅里叶变换近红外(Fourier Transform Near Infrared, FT-NIR)光谱仪 | Antaris II | 美国Thermo Fisher Scientific公司 |
| 大容量吸光比色皿 | 光程1mm | 德国Hellma公司 |
| MATLAB 数据处理软件 | 2015a | 美国Mathworks公司 |
3.1.2实验材料与试剂
表3-2 实验材料与试剂
| 试剂/材料 | 规格/批号 | 生产厂家 |
| 人血清白蛋白(Albumin human) | A9731-5G | Sigma-Aldrich公司 |
| 免疫球蛋白G(IgG from human serum) | I4506-50MG | Sigma-Aldrich公司 |
| 氯化钠 | 分析纯 | 国药集团化学试剂有限公司 |
3.2 NIR用于不同NaCl浓度下HSA结构变化的研究
3.2.1实验方法
NaCl水溶液二元体系的配制:配制NaCl水溶液,浓度范围为0-3.2 mol/L,0.4mol/L为一个梯度,即0 mol/L、0.4 mol/L、0.8 mol/L、1.2 mol/L、1.6 mol/L、2.0 mol/L、2.4 mol/L、2.8 mol/L、3.2 mol/L。
HSA的NaCl水溶液三元体系的配制:配制含有蛋白质HSA的NaCl水溶液,称取0.3000g HSA溶于2mL水中,维持每一个样品HSA的浓度为30mg/mL,配制HSA的NaCl水溶液,NaCl的浓度范围为0-3.2mol/L,0.4mol/L为一个梯度。
采集二元体系与三元体系的NIR光谱,温度为35℃,波长范围为10000-4000cm-1,2cm-1分辨率,64次扫描,光程长1mm,以空比色皿为背景进行扫描。每张光谱采集3次,最后进行平均处理。
3.2.2 光谱处理方法
在本实验中,将IgG的NaCl水溶液三元体系与IgG的水溶液二元体系进行差谱处理,通过差谱寻找某些波段范围内光谱的变化,探究其对应结构的变化。
为了增强光谱的分辨率,使用CWT处理原始光谱解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。
使用PCA的中心目的是将本次实验的数据降维,能够将光谱矩阵分解为几个向量的外积之和。分别选取CWT处理后的光谱4900-4200 cm-1段、8000-5500 cm-1段,进行PCA分析,进行结果分析。
3.2.3 结果与讨论
NaCl水溶液二元体系(下面简称二元体系)原始光谱图如图3-1,HSA的NaCl水溶液三元体系(下面简称三元体系)原始光谱如图3-2,波数范围为10000-4000cm-1。位于5100cm-1O-H基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了近红外光谱仪的检测上限,因此5100cm-1附近信号在本章中弃去。本章主要分析8000-5500cm-1和4900-4200 cm-1范围内的吸收峰。两个体系的原始光谱中,6944 cm-1左右的峰主要是水分子中O-H键的特征吸收峰,可以归属为O-H键伸缩振动的一级倍频。
在图3-1、图3-2中,随着NaCl浓度的升高,6944 cm-1 左右的峰高呈现依次增强且发生移动的规律性变化,分析其主要原因是NaCl浓度升高,Na+、Cl-、一些水分子会结合形成配位化合物,从而破坏了水分子的氢键。根据Buijs和Choppin的理论,NaCl会导致水分子间氢键发生断裂,且随着NaCl浓度的增大,溶液中离子的浓度增大,从而会导致吸收峰增强并向高波数方向移动。但是,也可以清晰看出,由于仪器响应、样品状态等原因,某些光谱产生了漂移或光谱的不重复,因此有必要对原始光谱进行预处理。
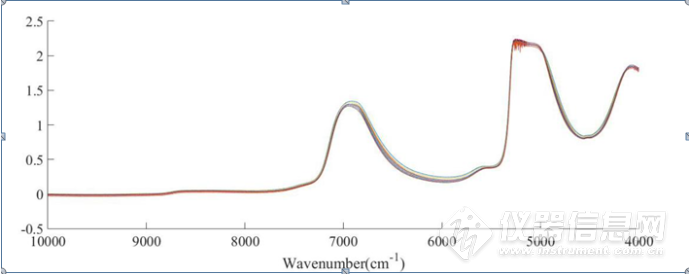
图3-1 0-3.2mol/LNaCl水溶液原始光谱
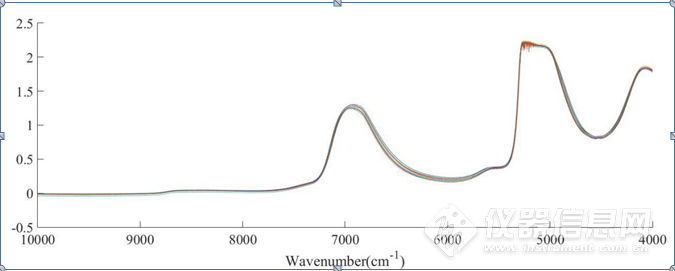
图3-2 HSA在0-3.2mol/L 的NaCl水溶液原始光谱,HSA的浓度为30mg/mL
分别对二元体系、三元体系的原始光谱进行SNV处理,去除基线漂移,如图3-3、图3-4所示,6944 cm-1左右、4900-4200cm-1范围内的光谱随NaCl浓度的变化呈现一定的规律性变化。
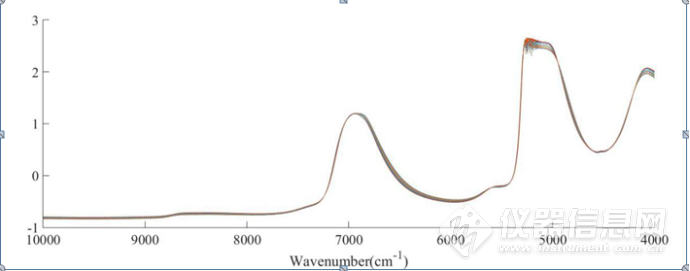
图3-3 NaCl水溶液原始光谱SNV处理后光谱

图3-4 HSA的NaCl水溶液原始光谱SNV处理后光谱
从二元体系与三元体系的近红外原始光谱中,很难提取出两者有效的光谱信息,为了研究NaCl对蛋白质HSA的结构影响,得到蛋白质对应信号的位置,将三元体系、二元体系的SNV处理后的光谱进行差谱处理。如图3-5所示:在7000 cm-1的差谱图附近呈现一系列峰的变化,该附近主要是水的吸收。从图中可以看出,在加入蛋白质HSA后,由于蛋白质与水形成新的氢键以及占据单纯的NaCl水溶液二元体系中水所占的百分比等,该波段左右的峰呈规律性的变化,分析其原因是由于NaCl水溶液的浓度不同,从而导致对水结构的影响大小不同,因此二元与三元体系的差谱会有一定的变化。在6000-5800cm-1 左右、5000-4200cm-1该处二元与三元体系的差谱呈现一定的规律性变化,在这两段波段附近,主要存在着蛋白质酰胺A/Ⅱ结构、酰胺B/Ⅱ结构、β-折叠结构、α-螺旋结构等结构的吸收峰,在三元体系中,不同浓度的NaCl对蛋白质的结构会产生一定的影响,因此,在差谱图中呈现一定的规律性变化。
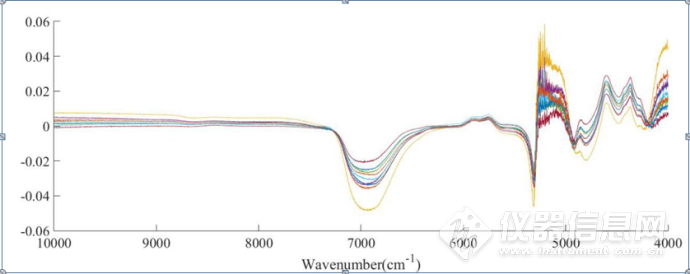
图3-5 三元体系与二元体系SNV处理后光谱的差谱
本章主要分析8000-5500 cm-1和4900-4200 cm-1范围内的吸收峰。前者可归属为O-H基团对称和反对称伸缩的组合频和N-H基团伸缩振动的一级倍频;后者是N-H、C-N和C-H基团伸缩或弯曲振动的组合频或一级倍频产生的重叠峰。为了分析NaCl对HSA的结构变化的影响,有必要增强光谱的分辨率来获得潜在的关于HSA的光谱信息。为了增强光谱的分辨率,使用CWT解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。处理结果如图3-6所示。
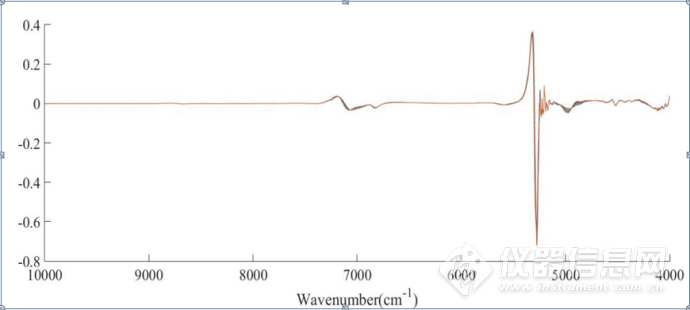
图3-6 HSA的NaCl水溶液三元体系CWT图

图3-7HSA的NaCl水溶液三元体系4900-4200 cm-1放大CWT图
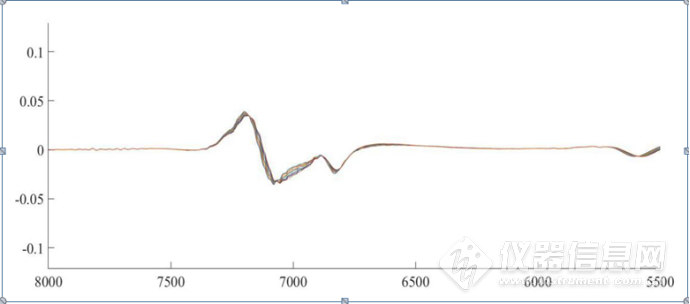
图3-8 HSA的NaCl水溶液三元体系8000-5500 cm-1 放大CWT图
如图3-7、图3-8所示,分别为三元体系在4900-4200cm-1、8000-5500cm-1 CWT图的放大图,经过小波变化之后,可以看到光谱信息得到放大,在7000 cm-1左右的羟基吸收峰处,出现随着NaCl浓度的升高,吸光度强度发生了不同的变化,大致上呈现强度减小的趋势,在4900-4200cm-1酰胺吸收区域,可以明显看到4820cm-1、4690cm-1、4650cm-1、4548cm-1、4476cm-1、4290cm-1处蛋白质的吸收峰,说明CWT对近红外光谱的分辨率进行了提高,可以提取出关于HSA结构的丰富信息。在羟基吸收区域,有两个明显的7150cm-1和6848cm-1处吸收峰。
(1)对酰胺吸收的4900-4200 cm-1段进行PCA分析
首先对4900-4200cm-1的光谱进行CWT处理,然后进行PCA分析。

图3-9 三元体系4900-4200 cm-1第一主成分与第二主成分得分图,1-9号为30 mg/mL HSA 分别溶解于对应浓度为0、0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2 mol/L的NaCl溶液的样品
如图3-9所示,从第一主成分与第二主成分得分图中可以看出,1-9号样品的第一主成分的得分呈现依次下降的趋势;而1-9号样品的第二主成分的得分没有明显的上升或者是下降的趋势,但是3号样品,即0.8 mol/L NaCl溶液,8号样品,即2.8 mol/L NaCl溶液,这两个浓度的样品第二主成分的得分明显上升,分析其原因可能是在该浓度下,NaCl 对蛋白质产生了较大的影响,从而引起蛋白质结构的改变。因为NaCl的加入,引入了Na +和Cl -,而离子的亲水性较强,所以这两种离子能够破坏蛋白质的水化膜 ,使蛋白质结构发生改变。
图3-10为三元体系4900-4200 cm-1第一主成分载荷图,图3-11 三元体系4900-4200 cm-1第一主成分得分图:
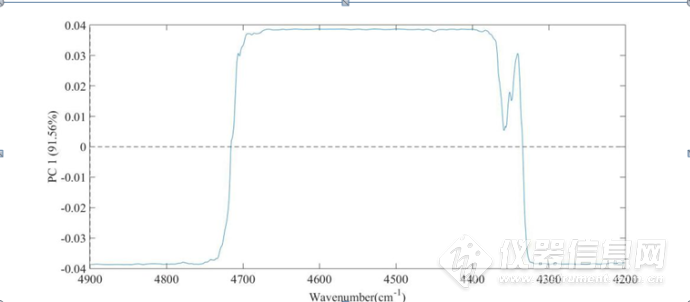
图3-10HSA的NaCl水溶液三元体系4900-4200 cm-1第一主成分载荷图
在第一主成分载荷图中可以看出,4700-4380cm-1、4360-4320cm-1波数范围内的峰对NaCl 水溶液的浓度较为敏感,该波段范围内主要存在蛋白质酰胺结构的吸收,从图中可以看出随着NaCl 水溶液的浓度的改变,引起了蛋白质结构的改变,这说明能够在第一主成分图中可以提取出蛋白质结构变化的信息。
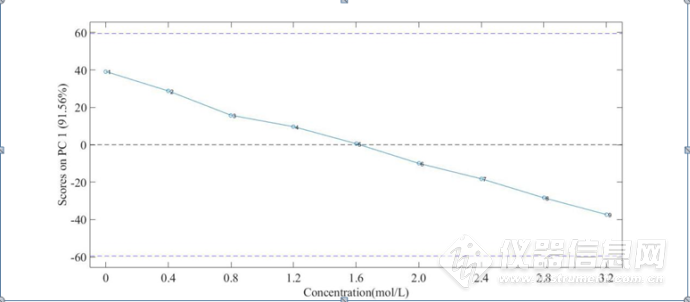
图3-11 HSA的NaCl水溶液三元体系4900-4200 cm-1第一主成分得分图
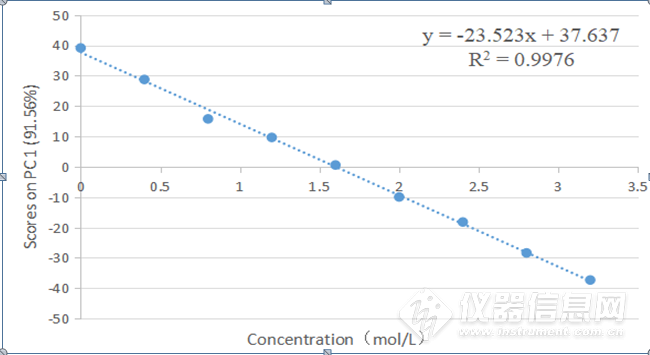
图3-12HSA的NaCl水溶液三元体系4900-4200 cm-1第一主成分得分图的线性回归图
将三元体系4900-4200 cm-1第一主成分得分图进行线性回归处理,如图3-12所示。R2=0.9976,说明该波段第一主成分的得分与NaCl 水溶液的浓度呈现较好的线性关系,因此可以用第一主成分来预测NaCl 水溶液的浓度。
(2)对8000-5500cm-1羟基吸收区域进行PCA分析
在HSA水溶液中,存在着水分子和HSA的相互作用。HSA的结构变化可能影响周围水分子的结构,水分子也可能在HSA的结构变化中扮演着重要的角色,在HSA的NaCl水溶液中,Na+、Cl-是亲水性离子,会影响水分子的结构及分布,在光谱中对应的波数范围内会有所体现,因此研究水的光谱具有一定的意义。
首先进行CWT处理后进行PCA分析,图3-13为三元体系8000-5500 cm-1第一主成分与第二主成分得分图。从图中可以看出,1-9号样品的第一主成分的得分呈现依次上升的趋势;而1-9号样品的第二主成分的得分没有明显的上升或者是下降的趋势,1号样品,不含NaCl,其得分明显高于其他样品的得分,当加入NaCl后,其第二主成分的得分明显下降,因此可知近红外光谱能够体现水结构发生了改变,在较低浓度时,随着NaCl浓度的增大,第二主成分的得分大致呈现下降的趋势,但当NaCl浓度大于2.0mol/L得分几乎不变,3.2mol/L样品的得分有所升高,可知第二主成分的得分并不呈现明显的规律性变化。

图3-13三元体系8000-5500 cm-1第一主成分与第二主成分得分图,1-9号为30mg/mL HSA 分别溶解于对应浓度为0、0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2mol/L的NaCl溶液的样品
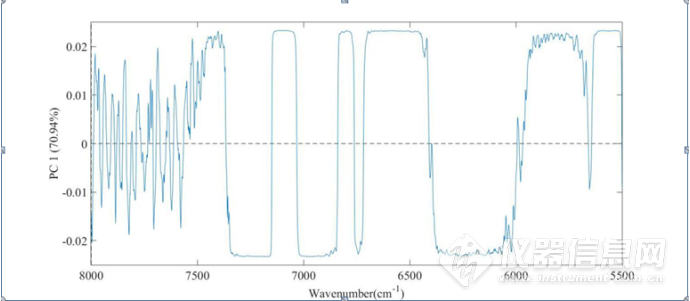
图3-14三元体系8000-5500 cm-1第一主成分载荷图
在三元体系8000-5500 cm-1第一主成分载荷图中可以看出,8000-7300cm-1波段范围内,信号较为嘈杂,因此无法提取有效信息。7050-7200cm-1左右、4360-4320cm-1 波束范围内的峰对NaCl 水溶液的浓度较为敏感,说明NaCl 水溶液的浓度的改变,对蛋白质结构产生了一定的影响,因此可以在第一主成分图中可以提取出蛋白质结构变化的信息。
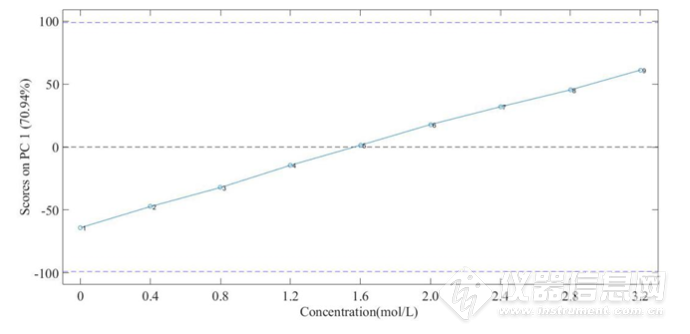
图3-15三元体系8000-5500 cm-1第一主成分得分图
将HSA的NaCl水溶液三元体系8000-5500 cm-1第一主成分得分图进行线性回归处理,如图3-16所示。R2=0.9989,说明该波段第一主成分的得分与NaCl 水溶液的浓度呈现较好的线性关系,因此可以用第一主成分来预测NaCl 水溶液的浓度。
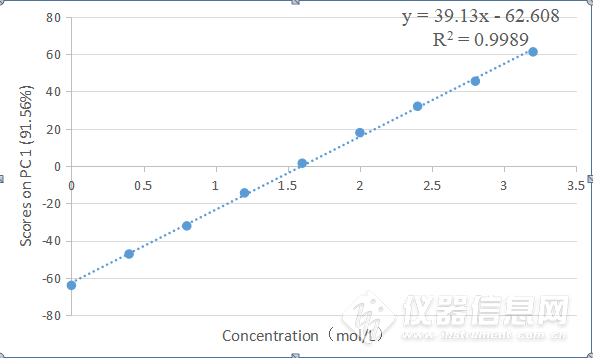
图3-16三元体系8000-5500 cm-1第一主成分得分图的线性回归图
3.3NIR用于不同NaCl浓度下IgG结构变化的研究
3.3.1 实验方法
NaCl水溶液二元体系的配制:配制NaCl水溶液,浓度范围为0-2.4 mol/L,0.2 mol/L为一个梯度,即0 mol/L、0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L、1.2 mol/L、1.4 mol/L、1.6 mol/L、1.8 mol/L、2.0 mol/L、2.2 mol/L、2.4 mol/L。
IgG的NaCl水溶液三元体系的配制:配制含有蛋白质IgG的NaCl水溶液,维持每一个样品IgG的浓度为5 mg/mL, NaCl的浓度范围为0-2.4 mol/L,每0.2mol/L为一个梯度。
采集二元体系与三元体系的NIR光谱,温度为35℃,波长范围10000-4000cm-1,2cm-1分辨率,64次扫描,光程长1mm,以空比色皿为背景进行扫描。每张光谱采集3次,最后进行平均处理。
3.3.2结果与讨论
NaCl水溶液二元体系(下面简称二元体系)原始光谱图如图3-17,IgG的NaCl水溶液三元体系(下面简称三元体系)原始光谱如图3-18,波数范围为10000-4000cm-1。位于5100 cm-1O-H基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了近红外光谱仪的检测上限,因此5100cm-1附近信号在本章中弃去。本章主要分析8000-5500cm-1和4900-4200 cm-1范围内的吸收峰。两个体系的原始光谱中,6944 cm-1左右的峰主要是水分子中O-H键的特征吸收峰,可以归属为O-H键伸缩振动的一级倍频。图3-17、图3-18中随着NaCl浓度的升高,该波段的峰高呈现依次下降的规律性变化,但是,也可以清晰看出,由于仪器响应、样品状态等原因,某些光谱产生了漂移或光谱的不重复,因此有必要对原始光谱进行一些预处理。

图3-17 NaCl水溶液二元体系原始光谱图
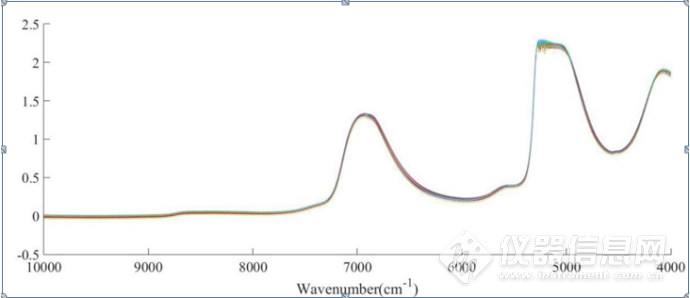
图3-18 IgG的NaCl水溶液三元体系的原始光谱图
分别对二元体系、三元体系的原始光谱进行SNV处理,去除基线漂移,如图3-19、图3-20所示,6943 cm-1左右、4900-4200 cm-1范围内的光谱随NaCl浓度的变化呈现一定的规律性变化。
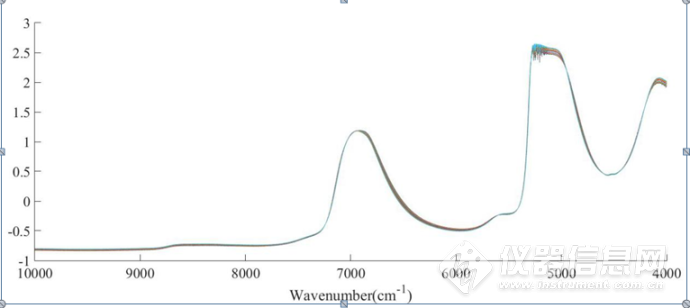
图3-19 NaCl水溶液二元体系原始光谱SNV处理后光谱

图3-20 IgG的NaCl水溶液三元体系原始光谱SNV处理后光谱
从二元体系与三元体系的近红外原始光谱中,很难提取出两者有效的光谱信息,为了研究NaCl对蛋白质IgG的结构影响,得到蛋白质对应信号的位置,将三元体系、二元体系的SNV处理后的光谱进行差谱处理。如图3-21所示,在7000 cm-1附近呈现一系列峰的变化,该附近主要是水O-H的吸收,在加入蛋白质IgG后,由于蛋白质与水形成新的氢键以及占据单纯的NaCl水溶液二元体系中水所占的百分比等,从图中可以看出,该波段左右的峰呈规律性的变化,分析其原因是由于NaCl的浓度不同,从而导致对蛋白质的影响大小不同,因此二元与三元体系的差谱会有一定的变化。在5000-4200cm-1范围内的二元与三元体系的差谱呈现一定的变化,在该段波段附近,主要存在着蛋白质酰胺A/Ⅱ结构、酰胺B/Ⅱ结构、β-折叠结构、α-螺旋结构等结构的吸收峰,在三元体系中,NaCl对蛋白质的结构会产生一定的影响,因此,在差谱图中呈现一定的趋势性变化。
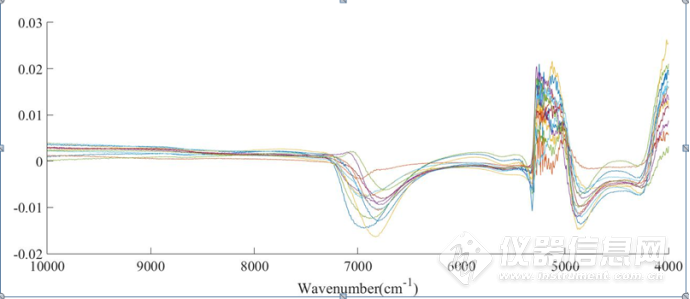
图3-21 IgG的NaCl水溶液三元体系与NaCl水溶液二元体系SNV处理后光谱的差谱
本章主要分析8000-5500 cm-1和4900-4200 cm-1范围内的吸收峰。前者可归属为O-H基团对称和反对称伸缩的组合频和N-H基团伸缩振动的一级倍频;后者是N-H、C-N和C-H基团伸缩或弯曲振动的组合频或一级倍频产生的重叠峰。为了分析NaCl对IgG结构变化的影响,非常有必要增强光谱的分辨率来获得潜在的关于IgG的光谱信息。为了增强光谱的分辨率,使用CWT解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。处理结果如图3-22所示。

图3-22 IgG的NaCl水溶液三元体系CWT图
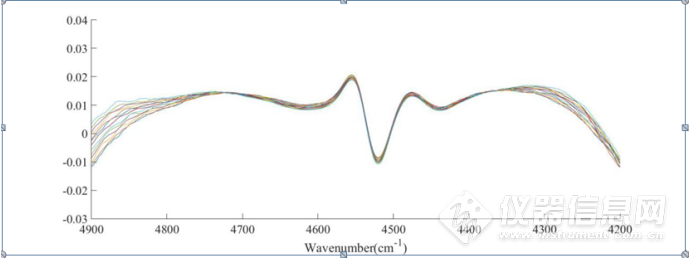
图3-23 IgG的NaCl水溶液三元体系4900-4200 cm-1放大CWT图

图3-24 IgG的NaCl水溶液三元体系8000-5500 cm-1放大CWT图
如图3-23、图3-24所示,分别为IgG的NaCl水溶液三元体系在4900-4200 cm-1、8000-5500 cm-1CWT图的放大图,经过小波变化之后,可以看到光谱信息得到放大,在7000cm-1左右的羟基吸收峰处,出现随着NaCl浓度的升高,吸光度强度发生了不同的变化,在4900-4200cm-1酰胺吸收区域,可以明显看到4550cm-1、4460cm-1处蛋白质的吸收峰,说明CWT处理对近红外光谱的分辨率进行了提高,可以提取出关于IgG结构的丰富信息。并且在羟基吸收区域,有两个明显的7180cm-1和6900cm-1处吸收峰。
对CWT处理后的4900-4200 cm-1的光谱进行PCA分析,如图3-25所示,从第一主成分与第二主成分得分图中可以看出,1-13号样品的第一主成分的得分呈现依次下降的趋势。而在第二主成分中,1-13号样品的得分没有明显的上升或者是下降的趋势,但是3号样品,即IgG 0.4 mol/LNaCl溶液,11号样品,即2.2 mol/L NaCl溶液,其第二主成分的得分明显上升,分析其原因可能是在这两个浓度下,NaCl 对蛋白质结构产生了较大的影响,从而引起蛋白质结构的改变,可以推测在IgG0.4 mol/L NaCl溶液中,低浓度的NaCl促进了蛋白质结构的疏水作用,而随NaCl浓度升高,离子强度增大,破坏了蛋白质水化膜的结构,从而改变了蛋白质的分子构象。
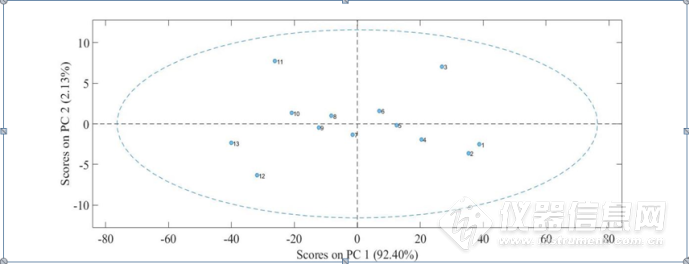
图3-25IgG的NaCl水溶液三元体系4900-4200 cm-1第一主成分与第二主成分得分图,1-13号为4 mg/mL IgG分别溶解于对应浓度为0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4 mol/L的NaCl溶液的样品
图3-26为三元体系8000-5500cm-1第一主成分与第二主成分得分图,可以从图中看出,在第一主成分中,1-13号样品的得分大致呈现下降的趋势,在第二主成分中,7号样品得分明显增高,即可以推测 IgG的1.2 mol/L的NaCl溶液,推测在1.2 mol/L左右,NaCl引起了水的结构较大的变化。
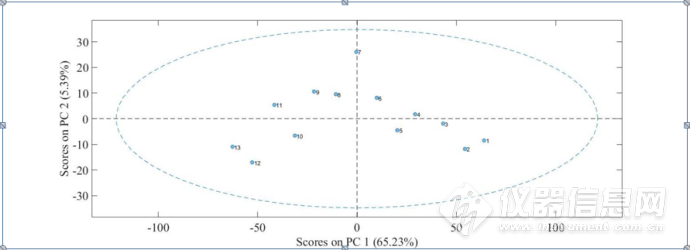
图3-26三元体系8000-5500cm-1第一主成分与第二主成分得分图,1-13号为4 mg/mL IgG分别溶解于对应浓度为0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4 mol/L的NaCl溶液的样品
3.4 结论
NaCl和蛋白质水溶液的所组成的体系中,含有Na+、Cl-,NaCl通过破坏蛋白质的周围水分子的结构,使蛋白质溶解度降低,导致蛋白质分子被从溶液中解离出来;NaCl的浓度改变,即溶液离子强度发生改变,可以破坏疏水作用力 ,以及改变蛋白质的分子构象,在光谱中水吸收的波段呈现一定的变化,在PCA处理的得分散点图中,能够得到一定的信息,但是若要进一步对各种结构的变化进行归属、分析,还需更完善的实验方案。
通过本章的研究可以知道,NaCl在蛋白质的水溶液中,对蛋白质与水的结构均具有一定的影响,但是与NaCl的浓度并不完全呈现一定的规律性。在较低离子浓度时,可能会促进蛋白质的溶解,而在离子浓度增加时,可能会破坏蛋白质的水化膜结构,从而导致蛋白质结构发生变化。
参考文献
胡小玲,郭小青,管萍,钱立伟.在离子液体中蛋白质溶解性和稳定性的研究进展.功能材料,2013,44(12):1679-1685.
查锡良, 药立波. 生物化学与分子生物学. 8版. 北京:人民卫生出版社,2013.
Lin Jie,Zhou Jing,Chris W Beown.Applied Spectroscopy,1996,50(4):444.
.



























