现代光谱分析技术结合化学计量学的中药过程质量控制研究进展
杨丽萍a,刘雨a,张露文a,卞希慧a,b*
a 天津工业大学,化学工程与技术学院,天津,300387,中国
b 山东大学,药物制剂技术研究与评价国家重点实验室,济南,250012
摘要:中药过程质量控制是确保中药产品药效稳定的关键,也是推动中药现代化和国际化的重要保障。然而,中药化学成分复杂,其生产过程涉及的中药材、中间体和制剂环节受到多种因素影响,给中药质量控制带来了重大挑战。随着人工智能技术的兴起和发展,现代光谱分析技术结合化学计量学方法能够有效提取中药中的化学信息,为中药分析提供智能化保障。本文综述了过去20年现代光谱技术结合化学计量学方法在中药过程质量控制中的研究进展。首先总结了应用于中药分析的近红外光谱、红外光谱和拉曼光谱等8种光谱技术的原理和优缺点。然后介绍了中药分析涉及的化学计量学方法,包括数据分组、预处理、变量选择、化学模式识别和多元校正;最后从中药过程质量控制的角度列举了光谱技术结合化学计量学应用实例,包括中药材的产地鉴别、掺假鉴别、品种鉴别、野生和栽培鉴别;中药中间体的成分监测、化学分析和生物标志物评估;中药制剂的溶出行为分析、过期样品的鉴别等。通过中药全程智能化和数字化分析,推动整个中药产业的现代化发展。
关键词:中药;现代光谱分析技术;化学计量学;过程质量控制
1.引言
中药在治疗各种疾病方面具有疗效显著、副作用小、毒副作用低等优点,越来越受到世界的认可[1]。随着全球对自然疗法和整体治疗方法的追求,中药已步入国际化和现代化进程[2]。然而,由于中药品种繁多、成分复杂、产地分散等各种因素,中药质量和临床疗效面临着很大差异[3]。传统的中药分析方法主要包括观、摸、闻、尝,以及一些简单的物理和化学方法,如根据形状、质地、气味和细胞含量来分析中药质量[5]。但这些方法需要从丰富的实践经验中获得专业知识,无法提供全面的评估[6],已难以适应现代医学的快速发展。鉴于中药通常由多种成分组成,每种成分具有不同的药理作用,因此目前有许多方法来监测中药的质量,包括薄层色谱(Thin-Layer Chromatography,TLC)、气相色谱(Gas Chromatography,GC)、高效液相色谱(High-Performance Liquid Chromatography,HPLC)和指纹图谱技术[7,8]。然而,这些方法仪器昂贵且需要化学试剂来进行破坏性预处理,成本高昂且费时费力[9]。
现代光谱分析技术具有快速、简便和无损的特点,可以根据化合物的结构信息全面分析其化学组成。与色谱法和质谱法相比,它在样品前处理过程几乎不需要化学试剂[10]。同时,光谱技术操作方便,易于维护。但是中药样品的光谱存在谱峰重叠等各种问题,需要结合化学计量学才可以进行定性和定量分析。化学计量学是利用数学、统计学和计算机的方法与手段建立测量值和样本特性之间关系的学科,主要包含数据分组、光谱预处理、变量选择、化学模式识别和多元校正等。近20年来,光谱技术结合化学计量学在中药分析中逐渐得到了应用[11-13]。Huang等人回顾了过去10年太赫兹光谱技术在化学药物、中药和生物药物分析中的实际应用[12];Pan等人从数据集划分、数据预处理、数据降维、定性定量建模以及模型性能评价五个方面,总结了中药高光谱数据质量分析[13];Dai等人探讨了化学计量学在中药光谱和色谱分析中的应用及发展前景[11];Li等人从结构分析、鉴定、实时监测和质量评估四个方面总结了色谱、质谱、光谱和化学计量学等非靶向分析技术的优缺点及在中药分析中的应用[2]。尽管有单一的光谱技术在中药分析中的研究综述,但没有对近20年来各种光谱技术结合化学计量学在中药分析中的系统总结。
本文对近20年来光谱技术结合化学计量学用于中药过程质量控制的研究进行了分析概括。主要总结了用于中药分析的各种光谱学技术和化学计量学方法,以及这些方法在中药材、中间体和制剂中的质量控制应用,为中药智能制造保驾护航。
2.现代光谱分析技术
现代光谱分析技术是基于物质与光相互作用的分析方法,通过测量物质对不同波长光的吸收、散射、发射等现象来获取物质的光谱信息。根据光谱及其波长的产生方式,分为近红外(Near-Infrared,NIR)光谱、红外(Infrared,IR)光谱、拉曼(Raman)光谱、紫外-可见(Ultraviolet-Visible Spectroscopy,UV-Vis)光谱、荧光光谱(Fluorescence Spectroscopy,FS)、太赫兹光谱(Terahertz Spectroscopy,THz)、激光诱导击穿光谱(Laser-Induced Breakdown Spectroscopy,LIBS)、高光谱成像(Hyperspectral Imaging,HSI)等。对近20年内各种光谱分析技术在中药过程质量控制中的使用频率进行了统计,由图1可知,近红外光谱和红外光谱是中药研究中被广泛使用的技术,这是由于它们均对分子结构较敏感且具有快速、无损、无污染和多组分检测的优势,随着现代光谱技术的不断发展,其他光谱如高光谱和拉曼等也逐渐被应用到中药分析当中。
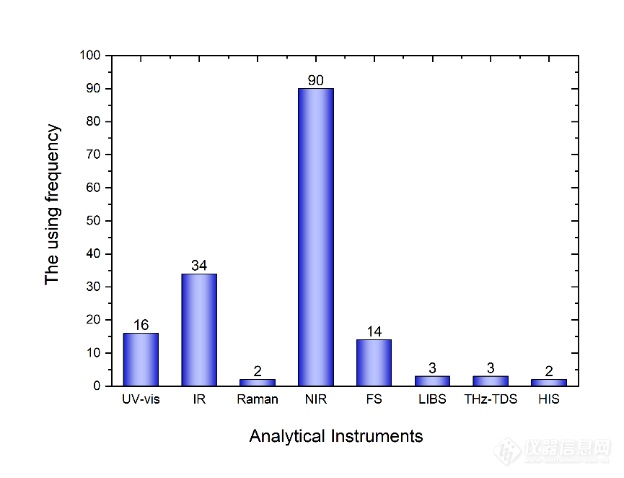
图1 现代光谱分析技术在中药过程质量控制中的使用频率
2.1 近红外光谱技术
近红外光谱技术具有快速、经济和无损的特点,是中药分析中最常用的光谱分析技术。它是一种振动光谱技术,由相对较弱和较宽的泛音以及主要与C-H、N-H、O-H和S-H等官能团相关的基本振动偏移带组成[14,15]。由于近红外光谱学是一种间接分析技术,因此首先需要确定已知样品的组成和特征。随后,使用最佳化学计量法建立校准模型,用于对未知草药样品进行定性和定量分析。近红外光谱技术不仅适用于固体、液体和生物技术药物形态的检测还可以应用于整个药物研发过程、生产过程监控和质量控制实验[16]。然而,其缺点主要在于较低的信号噪声比和灵敏度。将近红外光谱数据与化学计量学中的预处理方法相结合,可以提高其信号噪声比。此外,开发更灵敏的探测器或使用光纤来提高光收集效率,能够提高灵敏度和特异性。
2.2 红外光谱技术
红外光谱是指在红外光照射下,分子根据振动和转动能级跃迁对特定频率的光的吸收,其转动能级差异相对较小,主要出现在远红外区域(25-300μm)。相比之下,振动能级差异较大,主要出现在中红外区域(2.5-25μm)。通过对吸收峰的分析,得到分子结构和化学键组成的信息。红外光谱法在中药样品检测中的应用范围广泛,对固体和液体样本均适用[17]。同时,为了提高信噪比并检测低浓度的样品成分,傅里叶变换红外光谱(Fourier Transform Infrared,FTIR)应运而生[18]。然而,采用傅里叶变换红外光谱法分析那些不溶或难以粉碎的样品既耗时又具有挑战性。衰减全反射傅里叶变换红外光谱(Attenuated Total Reflectance FTIR,ATR-FTIR)技术省去了大量的预处理过程,从而简化了样品制备过程[19]。虽然红外光谱是一种快速、无损、高灵敏度的分析工具,但必须考虑样品的性质和具体的分析要求。同时,为了应用于野外和生产现场等不同环境,红外光谱技术的小型化和便携性将成为趋势。
2.3 拉曼光谱技术
拉曼光谱是一种利用分子振动期间极化率变化获得振动光谱的技术[20]。在中药分析中,拉曼光谱可以提供含有对非极性基团具有特异性的有机分子的草药的结构指纹。然而,拉曼光谱由于本身较小的截面积和通常较弱的散射光强度,不适用于检测浓度低于百万分之一(ppm)的分子[21]。为了解决信号质量差的问题,在原始技术的基础上发展出了几种变体,包括傅里叶变换拉曼光谱(Fourier Transform Raman Spectroscopy,FT-Raman)、共振拉曼光谱(Resonance Raman Spectroscopy,RRS)和表面增强拉曼散射光谱(Surface Enhanced Raman Scattering,SERS)[22]。其中,FT-Raman由于其较大的进光孔径,能够有效消除瑞利散射,从而确保光谱实验的高重现性。RRS受益于共振效应,这种效应显著增强了拉曼散射信号,能够实现对分子结构的精确分析和鉴定。SERS利用电磁和化学效应放大信号,从而实现对草药成分的高度特异性识别[23]。然而,其性能受到所用金属基材质量的影响。尽管传统拉曼光谱存在荧光干扰、湿度敏感和成分复杂等问题,但拉曼光谱的变种逐渐提高了对复杂混合物的识别能力,预计将被用于准确识别和分析中药材的分子结构。
2.4 紫外光谱技术
紫外-可见光谱可以用来阐明结构并确定因不饱和键而表现出紫外线吸收的物质的组成。它通过吸收曲线的轮廓或相应的吸收峰位置、强度和数量的变化来识别中药[24]。紫外吸收通常来源于生色团和助色团,主要与共轭体系或芳香体系相关。这些生色团存在于各种代谢产物中,如黄酮类、木脂素类、香豆素类和多酚类。相比之下,萜类化合物(包括皂苷类、三萜类和单萜类)通常缺乏这样的生色团,使得这些化合物的紫外吸收信息量较少[25]。此外,紫外-可见光谱所获得的光谱由于旋转、振动和电子跃迁具有复杂性,这使得对样本进行分类或区分变得具有挑战性。尽管面临诸多挑战,紫外可见分光谱仍因其成本效益和简便程序成为测定某些化合物的有利方法[26]。研究人员越来越多地将紫外-可见分光谱与化学计量学方法相结合来分析中药。例如,Bian等人使用紫外-可见光谱结合化学计量学对三七(Panax Notoginseng,PN)粉末进行了快速定量掺假研究。研究结果表明,预测浓缩PN及其三种掺杂物的最佳模型的相关系数(Rp)均高于0.98[27],该方法为快速和无损地量化掺杂PN样品提供了一种经济实惠的替代方案。
2.5 荧光光谱技术
荧光光谱技术因其灵敏度高、选择性好、相对经济等优点,被广泛用于定量分析[28]。然而,依赖于单一发射或激发光谱的传统荧光方法在提取完整荧光信息方面的能力有限,有时不足以用于复杂样品的分析[29]。而利用激发-发射矩阵(Excitation-Emission Matrix,EEM)可以为复杂系统快速获取更详细的光谱信息,显著提高了荧光技术的分析潜力[30]。此外,光谱学与化学计量学的结合已成为对复杂食品和中药进行表征和分类的强大工具。多向荧光指纹图谱结合模式识别技术形成了一种强大的分析方法,有利于对样品进行快速分类[31]。例如,Wu等人使用多重荧光指纹图谱结合四种模式识别的方法对不同省份的白术进行了分类[32]。结果显示,通过交叉验证集和偏最小二乘判别分析(Partial Least Squares Discriminant Analysis,PLS-DA)得到的预测集的正确分类率(Correct Classification Rate,CCR)分别为90.5%和100%。然而,面对α-香叶基香叶基和β-香叶基香叶基(如石竹类)等光谱信号的相似性,这些相关分析物之间存在着显著的光谱重叠和潜在的干扰风险。在这种情况下,三维荧光的应用有效实现了对复杂成分的全面分析。例如,Liu等人针对α-辛弗林和β-辛弗林光谱重叠严重的问题,建立了一种化学计量学辅助的EEM荧光方法[33]。实验结果表明,平均加标回收率为105.9%和89.7%,这对于复杂系统中不同标准品的测定是一个很大的改进。
2.6 太赫兹光谱技术
THz是指波长为0.3-3.0mm的电磁波,与其他波谱相比,THz因其光子能量低、频带宽、对非极性材料的穿透力高以及样品制备过程不需要物理和化学反应等优点,被广泛应用于材料、通信和生物医学等领域[34]。随着科技的进步和更深入的研究,其在中药领域的应用也在不断扩展。THz为精细的分子间振动和大分子框架的振荡提供了详细的见解。因此,它可以在分子水平上表征低频晶体振动、氢键伸缩、扭转振动和分子旋转。它主要用于中药的表征和结构分析[12]。然而,由于中药材的化学成分多样且复杂,THz很难直接模拟其分子结构。构建有效的分子结构模型进行模拟分析,可以极大地提升对与中药相关的特征吸收峰的理解。此外,中药中涉及的分子间相互作用,如范德华力、氢键和晶格振动等,都涉及到扩展状态,可以与红外光谱和拉曼光谱互补,在中药分析中发挥着不可替代的作用[35]。这些功能使THz可以与红外光谱和拉曼光谱相互补充,为分析提供了独特的工具。
2.7 激光诱导击穿光谱技术
LIBS是一种元素分析技术,通过激光照射目标物质产生等离子体,然后对发射的等离子体光谱进行采集和分析[36]。该方法利用激光诱导等离子体发射的光,通过元素的光谱特征进行识别和定量分析,从而确定中药的元素组成[37]。与传统的原子吸收光谱法(Atomic Absorption Spectrometry,AAS)、电感耦合等离子体原子发射光谱法(Inductively Coupled Plasma Atomic Emission Spectroscopy,ICP-AES)以及电感耦合等离子体质谱法(Inductively Coupled Plasma Mass Spectrometry,ICP-MS)不同,这些方法往往由于复杂的样品前处理而达不到实时测量的能力。LIBS以其分析快速、多元素分析能力、样品制备简单和在多种材料中进行多元素测定的高效性而脱颖而出。例如,Shen等人展示了LIBS技术对三七中钾、钙、镁、铁等元素定量分析的应用[38]。研究结果表明,采用适当的化学计量学技术与LIBS相结合,可准确快速地测定元素含量。然而,LIBS分析的灵敏度和精确性可能会受到限制,因为样品中其他元素所发射的谱线可能与待检测元素的谱线重叠或接近[39]。改进样品制备和采用化学计量学方法进行分析,旨在提高从光谱中定量提取信息的能力以及解读激光诱导等离子体发射光谱数据,这仍然是一个需要进一步发展的领域。
2.8 高光谱成像技术
HIS是将传统光谱原理与成像相结合的先进技术。它生成一个以空间维度(x和y)和光谱维度(λ)为特征的三维数据立方体,从而使用特定波段(λ)内每个像素的光谱信息增强二维灰度图像(x×y)[40]。HSI在中药分析中的应用主要集中在分类研究上。它解决了不均匀粉末样品所带来的挑战,并产生了可以观察掺杂剂分布的化学指纹,从而克服了传统成像技术缺乏提供光谱数据能力的根本限制[41]。尽管HIS有其优点,但它处理了大量的高维数据,导致计算时间较长。为此,选择相关变量和优化计算过程是缩短分析时间的关键策略[42]。这有助于高效开发所需的多光谱模型,从而充分发挥HSI在中药分析中的潜力。
3.化学计量学方法
3.1 样本分组方法
采集光谱数据后,需要将样本集分为用于训练模型的训练集和用于评估模型性能的测试集。同时,在模型构建中,需要检查模型的配置和训练程度。因此,可以将一部分训练数据设置为验证集,以检验模型的有效性[13]。选择合适的划分方法是获得具有良好预测性能的模型的关键步骤之一,具有代表性的训练集可以提高模型的预测能力。
常见的样本集分类方法有Kennard-Stone(KS)、基于联合x-y距离的样本集划分(Sample set portioning based on joint x-y distance,SPXY)法、随机抽样(Random Sampling,RS)法以及双面划分等。KS算法首先选择最远的两个样本作为初始训练集,然后从当前训练集中的所有样本中选择欧氏距离之和最大的样本加入训练集,直到达到指定的样本数[43]。同时,剩余的样本被用作测试集。此方法可确保训练集最大程度上具有代表性。Galvao等人基于KS方法对样品进行了化学测量距离的引入,并提出了SPXY方法[44]。SPXY通过计算X和Y空间中样本的联合距离来选择样本,全面考虑了光谱变量以及理化参数的影响。这确保了训练集和测试集在X和Y空间的表示和分布的均衡性。例如,Wang等人采用KS方法以2:1的比例选择校正集和验证集,用于PLS-DA结合茯苓的IR分析[45]。同时,采用SPXY方法将636个样品的数据集系统地分类为偏最小二乘回归(Partial Least Squares Regression,PLSR)模型的校正集和验证集,这确保了系统的划分和有效的模型评估。RS是从所有样本中随机选取一部分作为训练集,此方法操作简单。然而,这可能无法保证训练集和测试集在数据空间中的均匀分布,有时甚至可能导致模型的泛化能力不足[46]。Duplex通过交替选择距离当前选定样本集最远的样本来构建训练集和测试集,以尽可能地增加两个数据集之间的多样性。这种方法特别适用于需要多样化样本集以提高模型泛化能力的场景。然而,在过去20年中,很少有研究系统地比较了样本集方法及其对判别模型的影响。
3.2 预处理方法
在数据收集过程中,除了化学信息外,样品的物理性质和仪器响应的变化可能会引起电子噪声、光路变化或光散射效应。这些因素可能导致光谱内的非线性效应或引起基线漂移[47]。因此,对原始光谱数据进行预处理和分析以建立定性或定量模型至关重要。
预处理方法可分为:基线校正、散射校正、平滑和缩放。基线校正方法包括导数和连续小波变换(Continuous Wavelet Transform,CWT)。导数有助于减少光谱内的非线性效应或基线漂移,而CWT用于捕获信号的瞬时频率。它们都旨在减轻仪器背景噪声对光谱信号的影响[48]。此外,由于中药成分分布不均,仪器会产生散射光。为了消除散射光对光谱信号的影响,通常使用多元散射校正(Multiple Scattering Correction,MSC)和标准正态变量(Standard Normal Variable,SNV)进行校正。SNV和MSC之间的主要区别在于,SNV是从原始光谱中减去光谱的平均值,再除以光谱的标准差,本质上是将原始光谱数据标准化为标准正态分布[49]。相反,在校正光谱之前,MSC在原始光谱和平均光谱间进行一元线性回归,以获得每个样品的基线平移和偏移。最后,缩放技术旨在规范化数据尺度中的显著差异。主要包括均值中心化和归一化。均值中心化增强了样品光谱之间的区分度,有助于构建定量或定性的模型[50]。归一化将数据缩放到一个统一的范围,通过将变量的值映射到相同的区间来确保变量之间具有可比性。由于各种光谱技术都是基于不同的现象和不同的背景信号,因此需要根据仪器生成的数据序列结合建模效果来选择最优的预处理方法。一般来说,近红外光谱学具有显著的散射效应,需要使用散射校正。与近红外光谱相比,红外光谱具有更小的散射效应,因此在某些情况下可能不需要进行预处理[51]。拉曼光谱受到内在荧光背景的强烈影响,此影响可以通过使用基线校正来消除。此外,还有许多方法组合适用于光谱技术。例如,Ni等人使用NIR光谱数据进行预处理后对八角复合物进行了分类[52]。他们比较了MSC、SNV及其衍生物的特性。最终,他们根据系统在减少噪声和干扰方面的性能选择了SNV预处理方法。
3.3 变量选择方法
预处理后的光谱数据包含不相关或非线性变量,这些变量增加了计算任务,降低了模型性能。因此,变量选择对于建立一个具有强大预测能力和鲁棒性的校准模型至关重要。所选波段组合必须具有高信息含量、低相关性和强类别可分性,以提高后续建模分析的精度和效率。
常用的变量选择方法有连续投影算法(Successive Projections Algorithm,SPA)、变量投影重要性(Variable Importance in Projection,VIP)、竞争性自适应重加权采样(Competitive Adaptive Reweighted Sampling,CARS)和无信息变量剔除(Uninformative Variable Elimination,UVE)[53]。其中,SPA是一种前向选择方法,它提取整个光谱中的多个特征波长,最大限度地减少了向量空间中的共线性。VIP是一种基于偏最小二乘(Partial Least Squares,PLS)模型的回归方法,它通过变量对因变量的解释能力来评估变量的重要性。CARS是一种基于蒙特卡罗抽样的方法,它结合了一个指数衰减函数来控制变量的保留率,具有较高的计算效率。UVE是一种基于PLSR系数b建立的方法,它在选择波长时整合了噪声和浓度信息。
在近红外光谱技术的研究中,Ma等人利用CARS对预处理后的光谱进行分析,成功优化了样本PLS的关键波长组合[54]。结果表明,这种变量选择方法既准确又快速。在对八角进行分类的近红外或中红外光谱综合分析中,Ni等人选择了SPA和离散小波变换(Discrete Wavelet Transform,DWT)来对光谱进行变量选择[52]。他们发现,由于预处理模型所需的光谱特征较少,SPA的效果更好。
3.4 化学模式识别方法
当使用光谱技术从中药分析中获取数据时,有必要进行化学模式识别,将这些光谱数据转换为解决特定问题的可操作信息。这个过程涉及对不同样本中的特征进行分类和识别。图2展示了过去20年中应用于中药分析的主要化学模式识别方法。由图可知,在过去20年的中药分析中,主成分分析(Principal Component Analysis,PCA)和PLS-DA的应用频率较高,而极限学习机(Extreme Learning Machine,ELM)和随机森林(Random Forest,RF)相较于其他方法具有较低的应用频率。
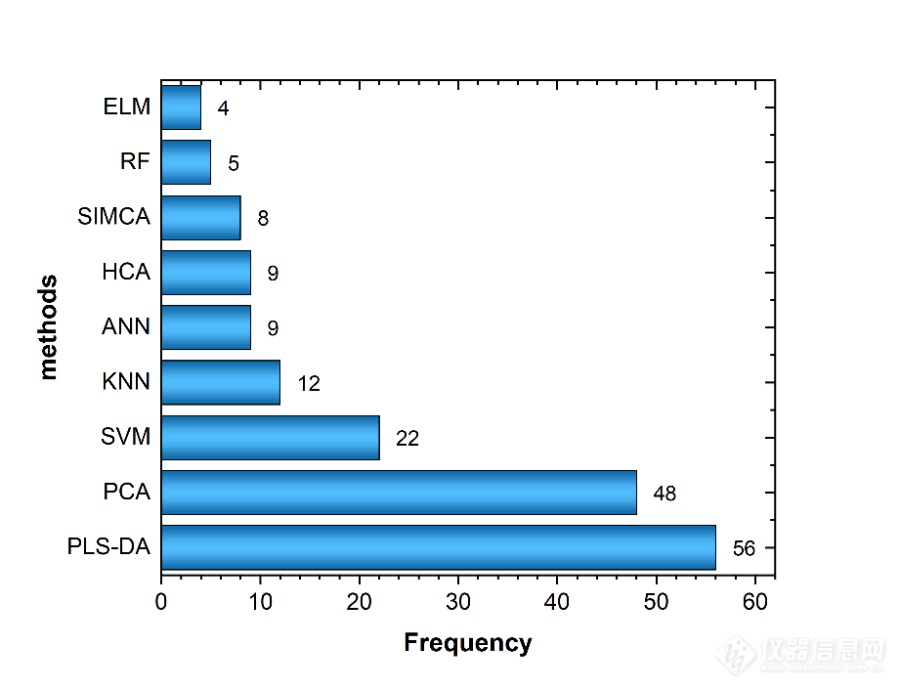
图2 过去20年用于中药分析的主要化学模式识别方法
从广义上讲,化学模式识别分为有监督和无监督方法。监督方法利用校准集或训练集中预先存在的数据来构建用于对新样品进行分类的模型。这些模型在应用于未知样本之前,需通过另一组已知特性的样本进行验证,以确认其预测准确性。监督模式识别技术被广泛用于分类。在中药分析中,最常用的包括PLS-DA、类比的软独立建模(Soft Independent Modeling of Class Analogy,SIMCA)、线性判别分析(Linear Discriminant Analysis,LDA)和人工神经网络(Artificial Neural Networks,ANN)。PLS-DA是最常用的分析方法,它可以测试最初跨越三个或更多主要组分的分离[55]。SIMCA在处理多个类别时非常有效,能够区分不同类别的内部变异性,并且能够将未知对象分类为一个或多个类别。LDA是一种特征还原方法,旨在实现不同类别之间的最大分离,它基于典型变体(Combination of typical variants,CVs)或具有强类别区分能力的判别函数的线性组合[56]。ANN由输入层、数据处理层和输出层组成,特别适用于非线性系统的建模。在一项使用FTIR建立不同地理来源的龙胆草鉴定模型的研究中,Wang等人利用PLS-DA建立了一个用于鉴定不同地理来源的人参的模型。验证结果表明,该模型对鉴定来自云南、贵州和四川的样本的准确率为100%,97.22%和100%[19]。
无监督模式识别缺乏监督学习的响应变量,旨在不依赖测量结果的情况下揭示数据结构中的潜在关系。它通过数据可视化和聚类分析,揭示个体之间的共通性和差异性,同时保留足够的信息并消除冗余和噪声。这包括层次聚类分析(Hierarchical Cluster Analysis,HCA)和PCA等。PCA通过降维将原始变量投影到主成分(Principal Components,PCs)中,用于数据可视化,因此它适用于处理大规模数据,但不考虑类别信息。HCA将观测数据划分为无标签的同类子集或集群,从而揭示数据集内部的子群结构。无监督模式识别方法对样本进行聚类并理解数据结构。然而,它缺乏识别样本分类的标准。中药分析的趋势是将PCA和HCA技术与监督分类相结合。例如,在使用THz分析白灵胶囊和金水宝胶囊之间的差异时,Zuo等人通过PCA获得了白灵胶囊和金水宝胶囊前两次主成分的累积贡献率,均在98%以上[57]。同时,他们使用聚类分析对来自不同批次的20种中药进行了分类。结果显示,金水宝胶囊的聚类准确率为100%,白灵胶囊的聚类准确率为81%。
3.5 多元校正
在分析中药复杂成分时,需要解决同时共存的多个成分之间相互干扰的问题。多变量校准方法通过建立组分浓度与光谱信息之间的关系,实现对未知样品中每个组分浓度的准确预测。它能够有效地处理中药中各种化合物的复杂混合,从而使分析结果更加可靠。一般来说,多元校准方法主要包括:线性校准与非线性校准。
线性校准应用最广泛的是PLS和主成分回归(Principal Component Regression,PCR)。PCR适用于具有较大协方差或条件较差的独立变量或预测变量的数据,它不考虑因变量并通过创建成分来解释变量的可变性[58]。相比之下,PLS考虑了因变量,并使用相对较少的成分来拟合因变量,大大减少了过拟合的问题。它可以处理协变量并接受多个变量,创建一个基于原始变量预测样本属性的PLS模型。例如,在利用EEM-FS对白术中的掺假进行定量研究时,Chen等人针对每种类型的掺假白术粉建立了PLSR模型来预测掺假水平[30]。结果表明,所建模型的校准均方根误差(Root Mean Square Error of Calibration,RMSEC)和验证均方根误差(Root Mean Squared Error of Validation,RMSEV)均低于2.34%,这充分证明了所建模型在定量分析各种粉末的掺假程度方面具有高效性。
在非线性校准中,有ANN、支持向量回归(Support Vector Regression,SVR)和ELM。ANN由许多简单的处理单元(或神经元)组成,并通过加权可修改互连连接。它在中医药中用于预测性的定性或定量建模。SVR可以看作是多元线性回归(Multivariate Linear Regression,MLR)的补充和局部加权回归(Locally Weighted Regression,LWR)的混合。它通过非线性变换将原始问题转化为线性问题,并在高维空间中进行线性求解。在训练过程中,ELM只需要设置隐藏层神经元的数量和隐藏层神经元的激活函数,就可以获得唯一的最优解。它具有参数选择简单、学习速度快和泛化能力强的特点。例如,Lu等人利用PLSR和ANN对黄酮类化合物的三元混合物进行了THz定量分析。结果表明,ANN是大豆苷类成分的最佳预测模型,预测集均方根误差(Root Mean Square Error of Prediction,RMSEP)为1.27%[59]。
4.应用
现代光谱技术结合化学计量学应用于中药过程质量控制,主要分为中药材、中间体和中药制剂三个环节。以丹参滴丸的制备流程为例,进行过程质量控制,如图3所示,首先是丹参、三七和冰片等中药材的道地、真伪、种类等鉴别分析,然后是三七总皂苷和冰片等中间体的化学生物成分检测,最后是丹参滴丸的溶出性分析。
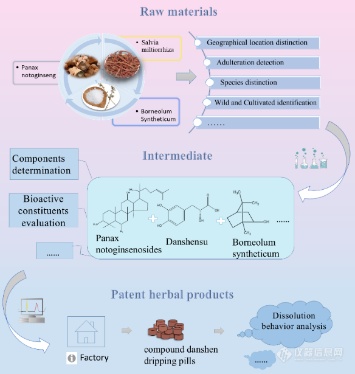
图3 复方丹参滴丸的中药过程质量控制流程图
4.1 中药材分析
中药材是中药的物质基础,涵盖了药用植物、动物和矿物等数千种资源,种类繁多。在过去20年中,光谱技术结合化学计量学在中药材分析领域得到了广泛应用,如图4所示,已有数十种中药材被当作研究对象,其中天麻、三七和丹参等研究最多。天麻因其在临床上降低血压、治疗眩晕头痛等疾病的显著效果而受到青睐。三七和丹参则因其活血化瘀的功效而备受关注,它们能够促进血液循环,消除血瘀,对心血管疾病具有显著的治疗效果。随着中药产业的持续发展,中药材的种植、加工和研发也在不断创新和完善。然而,中药材在道地性、真伪鉴别和物种鉴定等方面一直存在挑战,迫切需要现代光谱技术和化学计量学技术来解决这些问题。
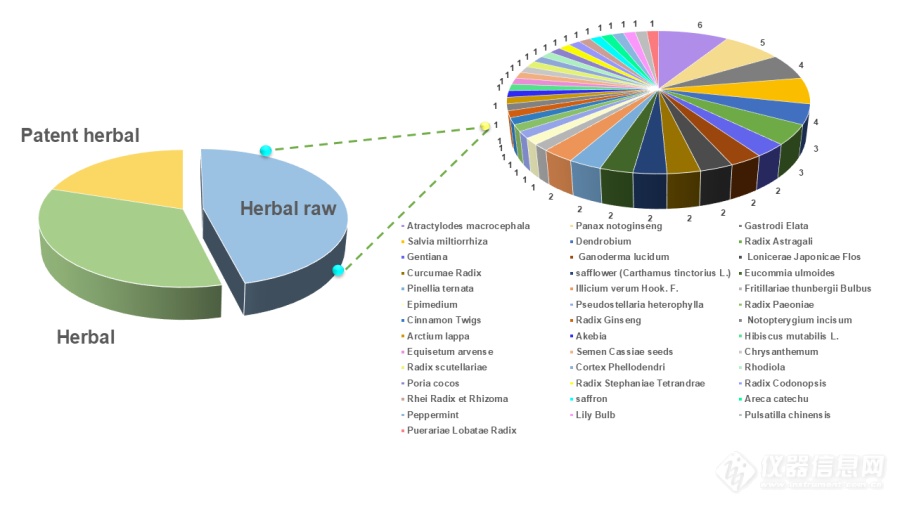
图4 现代光谱技术结合化学计量学用于中药材的研究数量统计
4.1.1 道地鉴别
众所周知,草药原料的含量和质量与原产地环境密切相关。受不同地区环境条件、气候和土壤成分等各种因素影响,同一类型的中药或同一科属的不同中药可能会在活性成分和药理作用上表现出显著差异。此外,中医药强调道地药材的重要性,这些药材一般生长在具有悠久种植历史、成熟的种植技术、高产量和优质品质的特定地区[60]。因此,分析不同地区草药原料的特性有助于了解其形成机制和影响因素,为优化栽培和生产提供科学依据。
橘皮(Citri Reticulatae Pericarpium,CRP)富含黄酮、挥发油、多糖和微量元素。它在抗炎、抗病毒和抗动脉粥样硬化方面起着重要作用。然而,由于气候、雨水、光照和土壤的影响,不同来源的CRP的药理作用和化学成分的积累是不同的[61]。其中,广东新会生产的CRP质量最好,市场价格远高于其他地方。近年来,市场对CRP的需求量很大,导致假冒产品频频出现。因此,有效区分CRP的地理来源已成为一个关键问题。目前,鉴别CRP来源的主要方法仍然依赖于颜色、形状和香气的差异。这种传统的感官体验虽然能够鉴别,但受主观因素的影响很大,有其局限性。而且,这种方法只能直观地区分是否是相似的CRP,并不能准确判断CRP的地理来源[62]。随着现代分析仪器与化学计量学的兴起,CRP的地理来源鉴定变得越来越可靠。例如,Fu等人提出了一种基于纳米粒子的荧光传感策略,结合光谱技术和化学计量学来识别CRP的地理来源。用传感器与不同来源的60批CRP提取物进行反应后,可以根据PLS-DA荧光颜色的显著差异,准确区分三种不同地理来源的CRP[63]。Su等人提出将THz技术与卷积神经网络(Convolutional Neural Network,CNN)相结合,以区分来自不同地理来源的CRP,同时不损害样品。研究发现,基于CNN的光谱与图像求和方法非常有效,准确率为86.17%[64]。Yu等人使用手持式近红外光谱仪结合RF、k-近邻算法(k-Nearest Neighbour,KNN)和LDA建立了一个判别模型。结果表明,该方法能够准确区分CRP的来源,同时正确识别率为96.99%[65]。
4.1.2 掺假检测
随着中药价格的上涨和资源的枯竭,不法商人为了追求利润最大化,通常选择掺假草药原料。掺假不仅会降低功效,还会严重危害健康。目前市场上最常见的掺假方法主要包括使用相似物质进行掺假、非法增重、染色和硫磺熏蒸。它在过去被开发用于识别特定的掺假行为[66]。然而,这些方法耗时、耗力且昂贵。因此,有必要建立可靠、省时且准确的方法来识别草药原料的掺假行为,以确保中药的安全性。
黄芪具有“益气”、补血、抗炎和降血压的功效。药理学研究表明,它对心脏、大脑和血管具有显著的保护作用[67]。近年来,由于黄芪的需求量和出口量巨大,商家为了迎合需求,通常会添加更便宜的相似材料来提高利润率。在这种情况下,黄芪中掺杂了金雀根,即豆科植物锦鸡儿的根。Yin等人采用漫反射中红外傅里叶变换光谱法(Diffuse Reflectance mid-infrared Fourier Transform Spectroscopy,DRIFTS)检测了6组伪黄芪样品中金雀根的含量。结果显示,PLS-DA模型对6组样本的预测准确率在95.00%到98.33%之间。同时,LDA-KNN也取得了较好的分类结果,其正确预测率在86.67%-100.0%之间[68]。预测结果证实,光谱技术与化学计量学相结合可以有效鉴定黄芪中的掺假量。此外,市场上还出现了多序岩黄芪的掺假物。Nie等人探索了红外光谱结合化学计量学检测黄芪掺假的可能性,以检测这种红色掺假物的掺假情况。结果显示,掺假样本的概率水平都低于5%,剔除率为77.8%[68]。
PN具有止血、降血糖和延缓衰老的功效。由于需求的增加和价格的上涨,市场上出现了许多假冒产品。PN掺杂了外观相似且价格较低的莪术(Rhizoma Curcumae,RC)、风姜(Rhizoma Alpiniae Offcinarum,RAO)和姜黄(Curcuma Longa,CL)。这些掺假产品不具备PN的功效,不仅不能治疗相应的疾病,而且对人体健康会产生有害影响[69]。因此,有必要查明PN的掺假情况,以保护消费者权益。然而,由于PN外观相似,消费者无法仅凭肉眼识别其纯度。Bian等人利用近红外光谱与化学计量学相结合的方法,研究了RC、CL和RAO中PN的鉴别方法。结果表明,PLS-DA和支持向量机(Support Vector Machine,SVM)对109个PN的识别准确率均可达到100%[70]。
4.1.3 物种鉴定
中药原料的物种相似性问题主要表现在形态特征难以区分,导致市场上存在大量的混造假品。由于不同物种的干燥根茎形态相似,传统的鉴定方法准确性和效率较低。这不仅影响原料用药的安全性和有效性,也给药材市场带来了一定的风险和挑战。因此,需要建立快速、可靠的物种鉴定方法,这对原料的质量控制、安全性和有效性具有重要意义。
菊花为菊科植物菊的头状花序,常见的药用品种有滁菊、贡菊、杭菊和亳菊。不同种类的菊花具有不同的化学成分,如黄酮、有机酸和生物碱等,但在外观上具有较大程度的相似性[69]。因此,非专业人员很难通过眼睛对其进行准确识别。然而,常规仪器检测成本高,分析时间长。Li等人利用便携式近红外光谱仪采集了滁菊、贡菊、杭菊和亳菊完整状及粉末状两种物理形态样品的光谱,采用单一以及组合光谱预处理方法消除光谱中存在的干扰,结合不同模式识别方法分别构建了不同品种菊花的鉴别模型。结果表明,经过连续小波变换预处理后,完整样品的光谱数据识别率为97.5%,粉末样品的原始光谱识别率为100%[71]。
霍山石斛是一种珍贵的中药,具有益胃生津、抗菌延年等显著功效。霍山石斛在市场上价格昂贵,且不同品种的治疗效果差异较大。在质量控制角度来看,建立一种快速、无损、准确的质量控制方法至关重要[72]。然而,基于生理学和解剖学分析的传统方法很难从干燥茎中鉴定霍山石斛物种。此外,化学方法具有破坏性。Zang等人使用微型近红外光谱仪对5种不同商业等级的90批次石斛样品进行了无损测定。结果表明,SNV具有100%的识别率和100%的拒收率[73]。
4.1.4 野生和栽培鉴定
由于土地资源的减少和生态环境的恶化,一些野生草药资源面临着流失和枯竭的问题,导致栽培与野生混杂无法区分。
天麻具有镇静、止痛和抗惊厥等药理性质,但是它在自然界中十分罕见。由于需求量的增加和昂贵的药用价值,廉价的栽培芦笋在市场上经常被野生芦笋所替代。利用传统方法区分栽培和野生栽培费时费力,因此有必要建立一种快速有效的方法来鉴定野生芦笋。Tan等人探索了将NIR技术和化学计量学相结合来识别野生和栽培芦笋的可行性。共采集了141个样本进行建模,得到独立测试准确率为87%。结果证明,NIR技术和化学计量学相结合是区分野生芦笋和栽培芦笋的有利工具。
茯苓菌核是一种应用广泛的中药,也是一种膳食补充剂。基于市场上栽培品种与野生品种之间的差异,Wang等人利用ATR-FTIR和超快速液相色谱结合PLS和PLSR对636个样品的光谱扫描和色谱图进行了野生品和栽培品的比较和定量分析[45]。结果表明,栽培药材中含有的脱氢块茎酸、椰油酸A和脱氢块茎烯酸与野生药材存在显著性差异。脱氢侧柏酸和侧柏酸仅在内部样品中有所不同(P<0.05)。利用光谱数据区分野生和栽培样品的效率在95.14%以上。
4.2 中药中间体
中药中间体是中药制备过程中产生的化学物质,可能是反应产物、中间体或在混合物过程中与原料相关的代谢产物。常见的草药中间体包括糖苷类、糖苷配基类、生物碱类、皂苷类、氨基酸类等。草药中间体过程分析是中药质量控制的一个重要方面。应根据药物的具体特性,考察其理化性质、化学成分、生物活性及与安全性相关的因素。对草药中间体进行分析有助于了解中药制备过程中的化学变化,进一步加深对中药药理作用的理解。
4.2.1 成分测定和监测
中药具有多种成分、化合物相容性、加工和制造技术。在处理过程中成分含量会发生动态变化。因此,需要寻找一种无损的方法对不同成分的含量进行实时测定和监测。
金银花溶液已被用作中药,具有抗炎、抗菌、抗病毒等作用。在现行的《中国药典》中,绿原酸被正式作为表征该药材质量的指标性成分[74]。因此在研究金银花溶液的质量时,有必要对绿原酸的含量进行测定。Qiao等人研究了PLS模型开发中低浓度校正范围和大样本集选择的策略。结果表明,决定系数(R2)为0.9648,校正标准误差(Standard Error of Calibration,SEC)为71.2 ppm,预测标准误差(Standard Error of Prediction,SEP)为74.9 ppm[75]。同时,在金银花溶液的乙醇沉淀过程中,需要进行有效的监控,以保证产品质量。然而,传统的乙醇沉淀过程是使用手动程序进行监测的。这些技术费时费力,有时需要经验丰富的技术人员。Shi等人使用两台NIR仪器结合PLS模型研究了金银花溶液乙醇沉淀过程中绿原酸含量的监测。根据计算出的公差区间对结果进行了验证,发现PLS模型的每个未来结果都将以至少95%的概率包含在±10%的可接受范围内[75]。
4.2.2 化学分析
中药的化学成分复杂多样,应对化学成分的种类、组成及各成分间的差异进行研究。因此在研究过程中需要采用多方面的分析方法,包括指纹图谱和特征光谱分析等技术。中间体的化学分析是保证中药安全性、有效性和一致性质量控制的关键。
天麻主要用于治疗头痛、惊厥和头晕等病症。研究表明,酚类化合物是天麻根茎发挥药效的主要成分[76]。然而,天麻的药理功效和活性成分在蒸制过程中受到不利影响。传统上,蒸制过程结束时的质量评估主要集中在天麻素的水平上,而往往忽略了其他有益成分的数量。这种疏忽可能导致活性成分含量变化表示的不完整,从而阻碍最佳终点的精确确定。Zuo等人进行的一项研究调查了近红外光谱技术在天麻蒸制过程中的适用性。他们利用大约十个实验室规模的批次,开发了一个定量模型来追踪四种特定化学成分(天麻素、对羟基苯甲醇、巴利森苷B和巴利森苷A)在整个蒸制过程中的变化[77]。结果表明,该模型具有很高的精度。
近年来,人参多糖、三七多糖和西洋参多糖因其潜在的抗氧化、抗肿瘤等药用价值而备受关注[69]。然而,传统的FTIR技术在准确地将光谱波段分配给特定的化学实体方面存在局限性。这一挑战需要开发一种新的分析技术来进行质量控制,并充分利用治疗益处。为此,Kuang等人开发了一种二维相关红外光谱(Two-dimensional correlation infrared spectroscopy,2DCOS-IR)方法。该方法实现了对人参多糖、三七多糖和西洋参多糖的快速表征和区分[78]。此外,使用化学计量学技术构建人参多糖含量的预测模型,该模型表现出很高的准确性,在未知样本中实现了100%的验证率。
4.2.3 生物标志物评估
中药往往由多种药材组成,导致其成分具有复杂性。生物标志物有助于鉴定和量化这些药物的活性成分,并评估其治疗效果。随着对中药生物标志物的研究,其在中药开发、临床应用和全球推广方面的潜在贡献预计将大幅增长。目前,人们正在积极寻找和验证适合生物标志物疗效评估的生物标志物。
茯苓,以其利水渗湿、健脾止泻和宁心安神等功效而闻名。根据其部位和功能,通常将其分为两种类型:茯苓和茯苓皮。茯苓的主要化学成分包括三萜类和多糖类,是其发挥药理作用的基础[79]。这些成分的可量化性和特异性对于茯苓质量生物标志物的预测分析至关重要。Zuo和同事采用化学计量学、指纹图谱和网络药理学相结合的方法,筛选和分析了三种成分作为茯苓和茯苓皮的潜在生物标志物[45]。此研究为临床用药的疗效和茯苓不同部位的合理使用奠定了理论基础。
4.3 中药制剂分析
中药制剂是可直接用于临床的标准化药物制剂。它们遵循特定的规格、配方和制备工艺。中药制剂种类繁多,可以根据其剂型进行分类。这些形式包括丸剂、散剂、颗粒剂、口服液和喷雾剂等。例如,在生产复方丹参滴丸时,从丹参、黄芪、甘草等中药材的选择到人参总皂苷等化合物的中间阶段,再到最终的片剂形式,整个生产过程涉及严格的质量控制[80]。中药制剂的质量控制过程既包括成品的定性定量分析,也包括成品的含量测定。随着现代科技的进步,中药制剂的分析已经从传统的经验方法发展为集化学、生物学、药理学和分析化学等多领域知识于一体的科学学科。
4.3.1 溶出行为分析
目前,中药多组分溶出的研究多采用整体研究方法,用于评价不同厂家、不同批次中药制剂之间的差异,以及体外、体内多组分之间的相关性和中药制剂在开发新型中药多组分中药制剂中的生物等效性。
中药固体制剂的溶出度差异不仅受中药提取物成分固有差异的影响,还受片剂生产过程中混合、制粒、压片和包衣等关键工序控制程度的显著影响[81]。在药品生产过程中,严格选择中药材质量并精确控制生产过程至关重要。此外,产品必须符合设计的溶出曲线,力求批次间保持一致的溶出行为,从而最大程度地保证产品的质量。这也对优化生产工艺和改进配方提出了重大挑战。Li等人研究了桂枝茯苓胶囊中7种标志物成分在不同条件下的溶出行为,并研究了同一厂家不同批次的产品之间溶出行为的一致性。结果表明,在较高的转速和盐酸介质中,各成分均有较快的溶出速率。不同批次的产品表现出相似的溶出行为,多个组分表现出同步的溶出行为和相似的药物释放特性。此研究为桂枝茯苓胶囊质量批次一致性评价、工艺的优化和配方的改进提供了参考。
在新药和仿制药的研发策略中,口服剂型的体外同时溶出行为是定量评价活性药物成分的有效性及其药物特性的最重要指标。这迫使该领域的科学家不断改进分析方法,以获得更可靠、准确和精密的结果,用于药物中药制剂的定量分析和溶出度测试。üstündag及其同事使用PLS和PCR同时估计和检测片剂中药制剂中的齐多夫定(zidovudine,ZID)和拉米夫定(lamivudine,LAM)的溶出度。他们获得了ZID和LAM的溶出曲线,揭示了含ZID和LAM的市售片剂的药物行为。结果表明,含有ZID和LAM的片剂的分析和溶出度试验结果具有良好的一致性。
4.3.2 过期样品鉴别
中药因其独特的治疗理念和丰富的草药资源,为全球医学领域贡献了宝贵的知识和实践经验。然而,中药制剂的保质期往往被忽视,这不仅关系到治疗的疗效,也直接关系到患者的健康和安全。与西药相比,中药制剂产品的保质期和有效期问题往往更为复杂,因为它们通常含有多种中药成分,这些成分可能会随着时间的推移而变化,从而影响疗效和安全性。希望通过对到期问题的研究,能够促进中药制剂的安全管理。同时,也期望未来的研究能够进一步优化保鲜技术,延长其保质期。
参枝苓口服液(Shenzhiling oral liquid,SZL)是一种传统的中药制剂,用于改善阿尔茨海默病(Alzheimer's Disease,AD)患者的行为和心理症状。在现行质量标准中,芍药苷和肉桂酸被选为SZL的质量控制指标。Nie和同事提出了一种将ATR-FTIR与化学计量学相结合的方法,以快速识别SZL的保质期和有效期。利用15批样品构建了定量和判别模型,采用PLSR对芍药苷和肉桂酸两个质量控制成分进行建模。采用判别分析(Discriminant Analysis,DA)来区分样品的保质期,并将样品按批次分为校准集和验证集。采用标准正态变量变换、多元散射校正、Savitzky-Golay平滑、导数法等多种数据预处理算法来降低系统干扰的影响。采用相关系数(Correlation Coefficient,CC)、CARS、区间偏最小二乘回归(Interval Partial Least Squares Regression,IPLS)等变量选择方法优化PLSR和DA模型。结果表明,ATR-FTIR结合化学计量学方法可以作为一种快速、简便、无损的方法来评价SZL是否过期。
5.结论
现代光谱分析技术与化学计量学的结合不仅优化了中药分析操作过程还精确了分析检测结果,在中药分析的中药材、中间体和中药制剂环节中取得了重大进展。随着人工智能和大数据技术的发展,中药过程质量控制将越来越趋于规范化和智能化。模型转移、数据融合和电子鼻舌等新兴技术将会与其他技术进行融合,形成更为强大的检测和分析系统。例如,将电子鼻舌与光谱技术、质谱技术等结合,可以实现更为精准的物质成分分析和检测。因此,在今后的研究要充分应用现代分析技术对中药过程质量控制进行相关分析,让中药质量可控成为现实。
参考文献
[1] Monakhova, Y. B., Holzgrabe, U., Diehl, B. W. K. (2018). Current role and future perspectives of multivariate (chemometric) methods in NMR spectroscopic analysis of pharmaceutical products. Journal of Pharmaceutical and Biomedical Analysis, 147, 580-589. https://dx.doi.org/10.1016/j.jpba.2017.05.034.
[2] Li, X., Liu, Z. Q., Liao, J., Chen, Q., Lu, X. Y., Fan, X. H. (2023). Network pharmacology approaches for research of Traditional Chinese Medicines. Chinese Journal of Natural Medicines, 21 (5), 323-332. https://dx.doi.org/10.1016/s1875-5364(23)60429-7.
[3] Busia, K. (2024). Herbal Medicine Dosage Standardisation. Journal of Herbal Medicine, 46. https://dx.doi.org/10.1016/j.hermed.2024.100889.
[4] Pan, D. P., Guo, Y. L., Fan, Y. F., Wan, H. T. (2024). Development and Application of Traditional Chinese Medicine Using AI Machine Learning and Deep Learning Strategies. American Journal of Chinese Medicine, 52 (03), 605-623. https://dx.doi.org/10.1142/s0192415x24500265.
[5] Luo, Y. D., Yang, H. B., Tao, G. C. (2024). Systematic review on fingerprinting development to determine adulteration of Chinese herbal medicines. Phytomedicine, 129. https://dx.doi.org/10.1016/j.phymed.2024.155667.
[6] Li, Y., Shen, Y., Yao, C.-l., Guo, D.-a. (2020). Quality assessment of herbal medicines based on chemical fingerprints combined with chemometrics approach: A review. Journal of Pharmaceutical and Biomedical Analysis, 185. https://dx.doi.org/10.1016/j.jpba.2020.113215.
[7] Yin, L. H., Zhou, J. M., Chen, D. D., Han, T. T., Zheng, B. S., Younis, A., Shao, Q. S. (2019). A review of the application of near-infrared spectroscopy to rare traditional Chinese medicine. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 221. https://dx.doi.org/10.1016/j.saa.2019.117208.
[8] Liang, H. Z., Yuan, S., Ma, X. L., Song, Q. Q., Song, Y. L., Tu, P. F., Jiang, Y. (2024). A quantitative chemomics strategy for the comprehensive comparison of Murraya paniculata and M. exotica using liquid chromatography coupled with mass spectrometry. Journal of Chromatography A, 1718. https://dx.doi.org/10.1016/j.chroma.2024.464736.
[9] Yang, X. Y., Zeng, P. P., Wen, J., Wang, C. L., Yao, L. Y., He, M. (2024). Gain deeper insights into traditional Chinese medicines using multidimensional chromatography combined with chemometric approaches. Chinese Herbal Medicines, 16 (1), 27-41. https://dx.doi.org/10.1016/j.chmed.2023.07.001.
[10] Liu, C. L., Zuo, Z. T., Xu, F. R., Wang, Y. Z. (2021). Authentication of Herbal Medicines Based on Modern Analytical Technology Combined with Chemometrics Approach: A Review. Critical Reviews in Analytical Chemistry. https://dx.doi.org/10.1080/10408347.2021.2023460.
[11] Dai, L. H., Guan, Y., Wang, B., Wang, L. Y. (2022). Current role and future perspectives of chemometrics in spectroscopic and chromatographic analysis of traditional Chinese medicines. Materials Express, 12 (2), 202-213. https://dx.doi.org/10.1166/mex.2022.2156.
[12] Huang, S. T., Deng, H. X., Wei, X., Zhang, J. Y. (2023). Progress in application of terahertz time-domain spectroscopy for pharmaceutical analyses. Frontiers in Bioengineering and Biotechnology, 11. https://dx.doi.org/10.3389/fbioe.2023.1219042.
[13] Pan, Y. X., Zhang, H. X., Chen, Y., Gong, X. C., Yan, J. Z., Zhang, H. (2023). Applications of Hyperspectral Imaging Technology Combined with Machine Learning in Quality Control of Traditional Chinese Medicine from the Perspective of Artificial Intelligence: A Review. Critical Reviews in Analytical Chemistry. https://dx.doi.org/10.1080/10408347.2023.2207652.
[14] Rohman, A., Nugroho, A., Lukitaningsih, E., Sudjadi. (2014). Application of Vibrational Spectroscopy in Combination with Chemometrics Techniques for Authentication of Herbal Medicine. Applied Spectroscopy Reviews, 49 (8), 603-613. https://dx.doi.org/10.1080/05704928.2014.882347.
[15] Yin, L. H., Zhou, J. M., Chen, D. D., Han, T. T., Zheng, B. S., Younis, A., Shao, Q. S. (2019). A review of the application of near-infrared spectroscopy to rare traditional Chinese medicine. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 221. https://dx.doi.org/10.1016/j.saa.2019.117208.
[16] Zhang, Z. M., Li, H. D., Yun, Y. H., Ma, P., Yi, L. Z., Ren, D. B., Zhang, L. X., Yan, J., Dong, N. P., Deng, B. C., Lu, H. M. (2018). Chemometrics in instrumental analysis of complex systems-in honor and memory of Yi-Zeng Liang. Journal of Chemometrics, 32 (11). https://dx.doi.org/10.1002/cem.3095.
[17] Liu, X. Y., Jiang, W. W., Su, M., Sun, Y., Liu, H. M., Nie, L., Zang, H. C. (2020). Quality evaluation of traditional Chinese medicines based on fingerprinting. Journal of Separation Science, 43 (1), 6-17. https://dx.doi.org/10.1002/jssc.201900365.
[18] Wang, X., Liu, X. T., Wang, J. H., Wang, G., Zhang, Y., Lan, L. L., Sun, G. X. (2021). Study on multiple fingerprint profiles control and quantitative analysis of multi-components by single marker method combined with chemometrics based on Yankening tablets. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 253. https://dx.doi.org/10.1016/j.saa.2021.119554.
[19] Zhao, Y. L., Yuan, T. J., Zhang, J., Wang, Y. Z. (2019). Geographic origin identification and rapid determination of four constituents of Gentiana rigescens by FTIR combined with chemometrics. Journal of Chemometrics, 33 (4). https://dx.doi.org/10.1002/cem.3115.
[20] Jin, L., Wang, S. F., Cheng, Y. Y. (2020). A Raman spectroscopy analysis method for rapidly determining saccharides and its application to monitoring the extraction process of Wenxin granule manufacturing procedure. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 241. https://dx.doi.org/10.1016/j.saa.2020.118603.
[21] Lin, J., Chen, W. W., Yu, Y., Lin, D., Feng, S. Y., Chen, R. (2016). Surface-enhanced Raman scattering spectroscopic analysis of Saposhnikovia divaricata decoction. Spectroscopy Letters, 49 (3), 204-207. https://dx.doi.org/10.1080/00387010.2015.1124280.
[22] Li, M. X., Fang, H., Chen, Y., Wang, T., Yang, J., Fu, H. Y., Yang, X. L., Li, X. F., Chen, Z. P., Yu, R. Q. (2022). Data fusion of synchronous fluorescence and surface enhanced Raman scattering spectroscopies for geographical origin traceability of Atractylodes macrocephala Koidz. Spectroscopy Letters, 55 (5), 290-301. https://dx.doi.org/10.1080/00387010.2022.2074039.
[23] Kucharska-Ambrozej, K., Karpinska, J. (2020). The application of spectroscopic techniques in combination with chemometrics for detection adulteration of some herbs and spices. Microchemical Journal, 153. https://dx.doi.org/10.1016/j.microc.2019.104278.
[24] Yan, B., Sun, G. X. (2018). Monitoring quality consistency of Liuwei Dihuang Pill by integrating the ultraviolet spectroscopic fingerprint, a multi-wavelength fusion fingerprint method, and antioxidant activities. Journal of Separation Science, 41 (6), 1182-1191. https://dx.doi.org/10.1002/jssc.201700620.
[25] Ren, X. Y., He, T., Wang, J. J., Wang, L., Wang, Y., Liu, X. Y., Dong, Y., Ma, J., Jia, J., Song, R. L., Fan, Q. Q., Wei, J., Yu, A., Wang, X. H., She, G. M. (2021). UV spectroscopy and HPLC combined with chemometrics for rapid discrimination and quantification of Curcumae Rhizoma from three botanical origins. Journal of Pharmaceutical and Biomedical Analysis, 202. https://dx.doi.org/10.1016/j.jpba.2021.114145.
[26] Xie, B. G., Gong, T., Gao, R., Liu, J., Zuo, J., Wang, X. L., Zhang, Z. R. (2009). Development of rat urinary HPLC-UV profiling for metabonomic study on Liuwei Dihuang Pills. Journal of Pharmaceutical and Biomedical Analysis, 49 (2), 492-497. https://dx.doi.org/10.1016/j.jpba.2008.10.022.
[27] Bian, X. H., Zhang, R. L., Wang, J., Liu, P., Lin, L. G., Tan, X. Y. (2022). Rapid quantification of adulterated Panax notoginseng powder by ultraviolet-visible diffuse reflectance spectroscopy combined with chemometrics. Chinese Journal of Analytical Chemistry, 50 (3). https://dx.doi.org/10.1016/j.cjac.2022.100055.
[28] El-Gindy, A., Hadad, G. M. (2012). Chemometrics in Pharmaceutical Analysis: An Introduction, Review, and Future Perspectives. Journal of Aoac International, 95 (3), 609-623. https://dx.doi.org/10.5740/jaoacint.SGE_El-Gindy.
[29] Wang, L., Wu, H. L., Yin, X. L., Hu, Y., Gu, H. W., Yu, R. Q. (2017). Simultaneous determination of umbelliferone and scopoletin in Tibetan medicine Saussurea laniceps and traditional Chinese medicine Radix angelicae pubescentis using excitation-emission matrix fluorescence coupled with second-order calibration method. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 170, 104-110. https://dx.doi.org/10.1016/j.saa.2016.07.018.
[30] Li, M. X., Li, Y. Z., Chen, Y., Wang, T., Yang, J., Fu, H. Y., Yang, X. L., Li, X. F., Zhang, G., Chen, Z. P., Yu, R. Q. (2021). Excitation-emission matrix fluorescence spectroscopy combined with chemometrics methods for rapid identification and quantification of adulteration in Atractylodes macrocephala Koidz. Microchemical Journal, 171. https://dx.doi.org/10.1016/j.microc.2021.106884.
[31] Li, F., Yin, C. L., Lv, K. D., Chen, W. B., Zhao, L. C., Liu, Z. M., Hu, L. Q. (2024). Rapid identification of Radix Astragali origin by using fluorescence probe combined with chemometrics. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 312. https://dx.doi.org/10.1016/j.saa.2024.124080.
[32] Chang, Y. Y., Wu, H. L., Wang, T., Chen, Y., Yang, J., Fu, H. Y., Yang, X. L., Li, X. F., Zhang, G., Yu, R. Q. (2022). Geographical origin traceability of traditional Chinese medicine Atractylodes macrocephala Koidz. by using multi-way fluorescence fingerprint and chemometric methods. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 269. https://dx.doi.org/10.1016/j.saa.2021.120737
[33] Bai, X. M., Liu, T., Liu, D. L., Wei, Y. J. (2018). Simultaneous determination of α-asarone and β-asarone in Acorus tatarinowii using excitation-emission matrix fluorescence coupled with chemometrics methods. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 191, 195-202. https://dx.doi.org/10.1016/j.saa.2017.10.011.
[34] Shao, Y. N., Zhu, D., Wang, Y. T., Zhu, Z., Tang, W. C., Tian, Z. G., Peng, Y., Zhu, Y. M. (2022). Moxa Wool in Different Purities and Different Growing Years Measured by Terahertz Spectroscopy. Plant Phenomics, 2022. https://dx.doi.org/10.34133/2022/9815143.
[35] Chang, T. Y., Liang, J., Wei, D. S., Cui, H. L. (2022). Molecular and Crystalline Vibration Characteristics of Baicalin Investigated By Terahertz Spectroscopy and Density Functional Theory. Ieee Transactions on Terahertz Science and Technology, 12 (6), 611-618. https://dx.doi.org/10.1109/tthz.2022.3198221.
[36] Wang, J., Shi, M., Zheng, P., Xue, S., Peng, R. (2018). Quantitative Analysis of Ca, Mg, and K in the Roots of Angelica pubescens f. biserrata by Laser-Induced Breakdown Spectroscopy Combined with Artificial Neural Networks. Journal of Applied Spectroscopy, 85 (1), 190-196. https://dx.doi.org/10.1007/s10812-018-0631-7.
[37] Liu, X. N., Che, X. Q., Li, K. Y., Wang, X. B., Lin, Z. Z., Wu, Z. S., Zheng, Q. S. (2020). Geographical authenticity evaluation of Mentha haplocalyx by LIBS coupled with multivariate analyzes. Plasma Science & Technology, 22 (7). https://dx.doi.org/10.1088/2058-6272/ab7eda.
[38] Shen, T. T., Li, W. J., Zhang, X., Kong, W. W., Liu, F., Wang, W., Peng, J. Y. (2019). High-Sensitivity Determination of Nutrient Elements in Panax notoginseng by Laser-induced Breakdown Spectroscopy and Chemometric Methods. Molecules, 24 (8). https://dx.doi.org/10.3390/molecules24081525.
[39] Liu, X. N., Zhang, Q., Wu, Z. S., Shi, X. Y., Zhao, N., Qiao, Y. J. (2015). Rapid Elemental Analysis and Provenance Study of Blumea balsamifera DC Using Laser-Induced Breakdown Spectroscopy. Sensors, 15 (1), 642-655. https://dx.doi.org/10.3390/s150100642.
[40] He, J., He, Y., Zhang, C. (2017). Determination and Visualization of Peimine and Peiminine Content in Fritillaria thunbergii Bulbi Treated by Sulfur Fumigation Using Hyperspectral Imaging with Chemometrics. Molecules, 22 (9). https://dx.doi.org/10.3390/molecules22091402.
[41] Tao, Y., Bao, J. Q., Liu, Q., Liu, L., Zhu, J. Q. (2023). Deep residual network enabled smart hyperspectral image analysis and its application to monitoring moisture, size distribution and contents of four bioactive compounds of granules in the fluid-bed granulation process of Guanxinning tablets. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 287. https://dx.doi.org/10.1016/j.saa.2022.122083.
[42] Cai, Z. Y., Huang, Z. H., He, M. Y., Li, C., Qi, H. N., Peng, J. Y., Zhou, F., Zhang, C. (2023). Identification of geographical origins of Radix Paeoniae Alba using hyperspectral imaging with deep learning-based fusion approaches. Food Chemistry, 422. https://dx.doi.org/10.1016/j.foodchem.2023.136169.
[43] Li, Y., Shi, X. Y., Wu, Z. S., Guo, M. Y., Xu, B., Pan, X. N., Ma, Q., Qiao, Y. J. (2015). Near-infrared for on-line determination of quality parameter of Sophora japonica L. (formula particles): From lab investigation to pilot-scale extraction process. Pharmacognosy Magazine, 11 (41), 8-13. https://dx.doi.org/10.4103/0973-1296.149674.
[44] Galvao, R. K. H., Araujo, M. C. U., José, G. E., Pontes, M. J. C., Silva, E. C., Saldanha, T. C. B. (2005). A method for calibration and validation subset partitioning. Talanta, 67 (4), 736-740. https://dx.doi.org/10.1016/j.talanta.2005.03.025.
[45] Wang, Q. Q., Zuo, Z. T., Huang, H. Y., Wang, Y. Z. (2020). Comparison and quantitative analysis of wild and cultivated Macrohyporia cocos using attenuated total refection-Fourier transform infrared spectroscopy combined with ultra-fast liquid chromatography. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 226. https://dx.doi.org/10.1016/j.saa.2019.117633.
[46] Fang, H., Chen, Y., Wu, H. L., Chen, Y., Wang, T., Yang, J., Fu, H. Y., Yang, X. L., Li, X. F., Yu, R. Q. (2022). Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry combined with chemometrics to identify the origin of Chinese medicinal materials. Rsc Advances, 12 (26), 16886-16892. https://dx.doi.org/10.1039/d2ra02040h.
[47] Tian, D. C., Chen, W. H., Xu, D. C., Xu, L. S., Xu, G., Guo, Y. C., Yao, Y. D. (2024). A review of traditional Chinese medicine diagnosis using machine learning: Inspection, auscultation-olfaction, inquiry, and palpation. Computers in Biology and Medicine, 170. https://dx.doi.org/10.1016/j.compbiomed.2024.108074.
[48] Xie, J., Cai, K., Wang, Y. (2003). Application of Continuous Wavelet Transform to Pulse Signal Processing. Journal of Chongqing University, 26 (1), 66.
[49] Shao, Q. S., Zhang, A. L., Ye, W. W., Guo, H. P., Hu, R. H. (2014). Fast determination of two atractylenolides in Rhizoma Atractylodis Macrocephalae by Fourier transform near-infrared spectroscopy with partial least squares. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 120, 499-504. https://dx.doi.org/10.1016/j.saa.2013.10.035.
[50] Wang, H. P., Chen, P., Dai, J. W., Liu, D., Li, J. Y., Xu, Y. P., Chu, X. L. (2022). Recent advances of chemometric calibration methods in modern spectroscopy: Algorithms, strategy, and related issues. Trac-Trends in Analytical Chemistry, 153. https://dx.doi.org/10.1016/j.trac.2022.116648.
[51] Peris-Díaz, M. D., Krezel, A. (2021). A guide to good practice in chemometric methods for vibrational spectroscopy, electrochemistry, and hyphenated mass spectrometry. Trac-Trends in Analytical Chemistry, 135. https://dx.doi.org/10.1016/j.trac.2020.116157.
[52] Wang, Y., Mei, M. H., Ni, Y. N., Kokot, S. (2014). Combined NIR/MIR analysis: A novel method for the classification of complex substances such as Illicium verum Hook and its adulterants. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 130, 539-545. https://dx.doi.org/10.1016/j.saa.2014.04.062.
[53] Gao, L. L., Zhong, L., Huang, R. Q., Yue, J. A., Li, L., Nie, L., Wu, A. L., Huang, S. Y., Yang, C. G., Cao, G. Y., Meng, Z. Q., Zang, H. C. (2024). Identification and determination of different processed products and their extracts of Crataegi Fructus by infrared spectroscopy combined with two-dimensional correlation analysis. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 310. https://dx.doi.org/10.1016/j.saa.2024.123922.
[54] Nie, L. X., Dai, Z., Ma, S. C. (2016). Enhanced Accuracy of Near-Infrared Spectroscopy for Traditional Chinese Medicine with Competitive Adaptive Reweighted Sampling. Analytical Letters, 49 (14), 2259-2267. https://dx.doi.org/10.1080/00032719.2016.1143479.
[55] Yang, A. L., He, X. X., Zhai, Y. J., Gu, C., Zhang, Y. J., Li, S., Chen, S. J., Wang, X. C., Zhang, Y. T. (2024). Quality Evaluation of Calyx of Diospyros Kaki Thunb. by Ultra-High Performance Liquid Chromatography - Mass Spectrometry (UHPLC-MS) Profiling and Fingerprinting and Chemometrics. Analytical Letters. https://dx.doi.org/10.1080/00032719.2024.2365432.
[56] Gad, H. A., El-Ahmady, S. H., Abou-Shoer, M. I., Al-Azizi, M. M. (2013). Application of Chemometrics in Authentication of Herbal Medicines: A Review. Phytochemical Analysis, 24 (1), 1-24. https://dx.doi.org/10.1002/pca.2378.
[57] Jiang, B. F., Yan, J. Y., Zuo, J., Zhang, C. L. (2020). Application of terahertz technology in the identification of traditional Chinese medicine. In Conference on Infrared, Millimeter-Wave, and Terahertz Technologies https://dx.doi.org/10.1117/12.2573923.
[58] Niu, J. M., Wang, X. Y., Zhou, S. L., Yue, J. R., Liu, Z. W., Zhou, J. (2024). Molecular authentication of commercial "Qian-hu" through the integration of nrDNA internal transcribed spacer 2 and nucleotide signature. Molecular Biology Reports, 51 (1). https://dx.doi.org/10.1007/s11033-024-09557-8.
[59] Yin, M., Wang, J. L., Huang, H. L., Huang, Q. P., Fu, Z. P., Lu, Y. L. (2020). Analysis of Flavonoid Compounds by Terahertz Spectroscopy Combined with Chemometrics. Acs Omega, 5 (29), 18134-18141. https://dx.doi.org/10.1021/acsomega.0c01706.
[60] Wang, J., Cai, Z. Y., Jin, C., Peng, D. D., Zhai, Y. N., Qi, H. N., Bai, R. B., Guo, X., Yang, J., Zhang, C. (2024). Species classification and origin identification of Lonicerae japonicae flos and Lonicerae flos using hyperspectral imaging with support vector machine. Journal of Food Composition and Analysis, 132. https://dx.doi.org/10.1016/j.jfca.2024.106356.
[61] Wang, H. P., Lin, Z. Z., Wang, H., Yang, X., Niu, N. (2024). Comprehensive identifying flavonoids in Citri Reticulatae Pericarpium using a novel strategy based on precursor ions locked and targeted MS/MS analysis. Scientific Reports, 14 (1). https://dx.doi.org/10.1038/s41598-024-60415-w.
[62] Li, Y. X., Zhao, W. H., Qian, M., Wen, Z. Y., Bai, W. D., Zeng, X. F., Wang, H., Xian, Y. P., Dong, H. (2024). Recent advances in the authentication (geographical origins, varieties and aging time) of tangerine peel (Citri reticulatae pericarpium): A review. Food Chemistry, 442. https://dx.doi.org/10.1016/j.foodchem.2024.138531.
[63] Lan, W., Wu, Y., Zhao, X. Y., Yang, W., Rao, Y. M., Liu, R., Chen, H. Y., Long, W. J., Yang, J., She, Y. B., Fu, H. Y. (2023). Rapid visual discrimination of Citri Reticulatae Pericarpium from different origins by fluorescent sensors based on aluminum ions and Ag nanoclusters. Sensors and Actuators B-Chemical, 380. https://dx.doi.org/10.1016/j.snb.2023.133329
[64] Pu, H. B., Yu, J. X., Sun, D. W., Wei, Q. Y., Li, Q. (2023). Distinguishing pericarpium citri reticulatae of different origins using terahertz time-domain spectroscopy combined with convolutional neural networks. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 299. https://dx.doi.org/10.1016/j.saa.2023.122771.
[65] Pan, S. W., Zhang, X., Xu, W. B., Yin, J. W., Gu, H. Y., Yu, X. Y. (2022). Rapid On-site identification of geographical origin and storage age of tangerine peel by Near-infrared spectroscopy. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 271. https://dx.doi.org/10.1016/j.saa.2022.120936
[66] Jiang, Y., Li, X., Zhao, W. J., Liu, F. J., Yang, L. L., Li, P., Li, H. J. (2024). Integration of untargeted and pseudotargeted metabolomics reveals specific markers for authentication and adulteration detection of Fritillariae Bulbus using tandem mass spectrometry and chemometrics. Journal of Pharmaceutical and Biomedical Analysis, 242. https://dx.doi.org/10.1016/j.jpba.2024.116013.
[67] Yang, J., Yin, C. L., Miao, X., Meng, X. R., Liu, Z. M., Hu, L. Q. (2021). Rapid discrimination of adulteration in Radix Astragali combining diffuse reflectance mid-infrared Fourier transform spectroscopy with chemometrics. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 248. https://dx.doi.org/10.1016/j.saa.2020.119251.
[68] Zhang, L., Nie, L. (2010). Discrimination of Geographical Origin and Adulteration of Radix Astragali using Fourier Transform Infrared Spectroscopy and Chemometric Methods. Phytochemical Analysis, 21 (6), 609-615. https://dx.doi.org/10.1002/pca.1242.
[69] Liu, Q., Zhang, Z. P., Ji, P., Liu, J. Q., Chen, B. X., Mingyao, E., Qi, H. Y., Hou, T., Huang, Q. X., Ding, L., Guo, C., Zhao, D. Q., Yang, W. Z., Wang, Z. Y., Li, X. Y. (2024). Ginseng polysaccharide components attenuate obesity and liver lipid accumulation by regulating fecal microbiota and hepatic lysine degradation. International Journal of Biological Macromolecules, 269. https://dx.doi.org/10.1016/j.ijbiomac.2024.131872.
[70] Liu, P., Wang, J., Li, Q., Gao, J., Tan, X. Y., Bian, X. H. (2019). Rapid identification and quantification of Panax notoginseng with its adulterants by near infrared spectroscopy combined with chemometrics. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 206, 23-30. https://dx.doi.org/10.1016/j.saa.2018.07.094.
[71] Li, J. Y., Yu, M., Li, M. Q., Zheng, Y., Li, P. (2022). Nondestructive Identification of Different Chrysanthemum Varieties Based on Near-Infrared Spectroscopy and Pattern Recognition Methods. Spectroscopy and Spectral Analysis, 42 (4), 1129-1133. https://dx.doi.org/10.3964/j.issn.1000-0593(2022)04-1129-05.
[72] Zhao, Y. J., Han, B. X., Peng, H. S., Wang, X., Chu, S. S., Dai, J., Peng, D. Y. (2017). Identification of "Huoshan shihu" Fengdou: Comparative authentication of the Daodi herb Dendrobium huoshanense and its related species by macroscopic and microscopic features. Microscopy Research and Technique, 80 (7), 712-721. https://dx.doi.org/10.1002/jemt.22856.
[73] Hu, T., Yang, H. L., Tang, Q., Zhang, H., Nie, L., Li, L., Wang, J. F., Liu, D. M., Jiang, W., Wang, F., Zang, H. C. (2014). Absolutely Nondestructive Discrimination of Huoshan Dendrobium nobile Species with Miniature Near-Infrared (NIR) Spectrometer Engine. Spectroscopy and Spectral Analysis, 34 (10), 2808-2814. https://dx.doi.org/10.3964/j.issn.1000-0593(2014)10-2808-07.
[74] Cheng, J. L., Guo, F. X., Wang, L. Y., Li, Z. G., Zhou, C. Y., Wang, H. Y., Liang, W., Jiang, X. F., Chen, Y., Dong, P. B. (2024). Evaluating the impact of ecological factors on the quality and habitat distribution of Lonicera japonica Flos using HPLC and the MaxEnt model. Frontiers in Plant Science, 15. https://dx.doi.org/10.3389/fpls.2024.1397939.
[75] Wu, Z. S., Du, M., Sui, C. L., Shi, X. Y., Qiao, Y. J. (2012). Development and validation of NIR model using low-concentration calibration range: rapid analysis of Lonicera japonica solution in ethanol precipitation process. Analytical Methods, 4 (4), 1084-1088. https://dx.doi.org/10.1039/c2ay05607k.
[76] Ma, T. Y., Chen, P. P., Dong, H. J., Wang, X. (2024). Identification of key anti-neuroinflammatory components in Gastrodiae Rhizoma based on spectrum-effect relationships and its mechanism exploration. Journal of Pharmaceutical and Biomedical Analysis, 248. https://dx.doi.org/10.1016/j.jpba.2024.116266.
[77] Zuo, Y. M., Yang, J., Li, C., Deng, X. H., Zhang, S. S., Wu, Q. (2020). Near-Infrared Spectroscopy as a Process Analytical Technology Tool for Monitoring the Steaming Process of Gastrodiae rhizome with Multiparameters and Chemometrics. Journal of Analytical Methods in Chemistry, 2020. https://dx.doi.org/10.1155/2020/8847277.
[78] Lu, Y. L., Liang, J., Zhou, F. Y., Kuang, H. X., Xia, Y. G. (2021). Discrimination and characterization of Panax polysaccharides by 2D COS-IR spectroscopy with chemometrics. International Journal of Biological Macromolecules, 183, 193-202. https://dx.doi.org/10.1016/j.ijbiomac.2021.04.124.
[79] Xiao, Y. B., Liu, S., Zeng, L. Z., Zhou, C. R., Peng, Y. S., Wu, Y., Yin, X., Peng, G. P. (2024). Effects of processing methods on the aroma of Poria cocos and its changing. Food Chemistry, 448. https://dx.doi.org/10.1016/j.foodchem.2024.139151.
[80] Chen, X. X., Zuo, X. R., Zhao, Y. Q., Huang, Y. H., Lv, C. X. (2023). Evaluation and clinical implications of interactions between compound Danshen dropping pill and warfarin associated with the epoxide hydrolase gene. Frontiers in Pharmacology, 14. https://dx.doi.org/10.3389/fphar.2023.1105702.
[81] Guo, H. J., Liu, S. Y. (2023). Cocrystallization of Active Pharmaceutical Ingredients Derived from Traditional Chinese Medicines. Chemical & Pharmaceutical Bulletin, 71 (5), 326-333.






