活到九十 学到一百 2008/08/13
⑵电泳 ①毛细管电泳(CE): 毛细管利用它进行寡糖的组成分析、纯度鉴定和结构电泳不仅仅是一种分离手段,糖化学家还可以归属[5]。它既可以对复杂寡糖进行直接分析,得到寡糖的微观不均一性的信息,又可以对寡糖的酶解产物进行定性和定量分析,从而得出寡糖链的完整结构。 ②SDS-PAGE-PVDF技术:利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳-聚偏氟乙烯薄膜电迁移技术[6]可以把电泳凝胶上的糖蛋白基本上定量地转移到聚偏氟乙烯薄膜上,在此膜上可以直接进行酸水解,然后分析其氨基酸和糖基组成;也可以在此膜上进行溴化氰降解、各种蛋白酶、糖肽酶和糖苷酶水解,以及把PVDF膜直接置于蛋白质[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]序列仪或质谱上进行序列分析,从而获得pmol级糖蛋白的肽链和糖链结构以及糖肽连接方式,其做法是首先将转移到PVDF膜上的蛋白质剪下,溶解后分成数个试样,再用酸水解确定所研究的蛋白质是否含有糖基和含有什么样的单糖组成,若是糖蛋白则可用糖苷酶,如PNGase、Endo H、Endo F2等对其进行酶解,又用HPAEC-PAD分析所得的寡糖链,从而推测出糖蛋白上的糖链结构。 ③荧光基团辅助的糖电泳[7]:荧光基团辅助的糖电泳,又称荧光基团标记的糖的聚丙烯酰胺凝胶电泳,是一种寡糖结构分析的简便方法。它可以用来对多个样品平行地进行寡糖样品的简单、快速、灵敏和高分辨率的分离及定量分析。它是通过对糖类分子的还原端羰基进行荧光基团衍生化标记后进行聚丙烯酰胺凝胶电泳,这既增强了寡糖分子的检测灵敏度(<10~12 mol),又使通常呈中性的糖类分子带上电荷在电泳体系中进行分离。荧光试剂主要有两种:8-氨基萘基-1,3,6-三磺酸和2-氨基吖啶酮。分别用于中性与酸性寡糖的分离。因为疑胶电泳可以很方便地使用通常所用的蛋白质疑胶电泳设备和缓冲液体系(只要把沉淀剂SDS省去即可),而且在一次电泳时可以平行地进行多个寡糖样品的对照分离,所以它与酶解方法结合能非常方便、快捷和灵敏地对寡糖进行结构分析,这种方法与前面的CE方法有着异曲同工之妙,但所需仪器设备却更为简便。 ⑶磁共振方法 NMR技术对寡糖及其糖肽结构研究工作具有举足轻重的作用。尽管糖链中氢谱重叠十分严重,但500MHz或600MHz的高分辨1H-NMR能准确测定结构表征基团(structure reporter groups)的化学位移和峰宽,精度可达0.001。糖链的各种结构特征,均可由这些结构表征基团的微小位移变化出来,此外2D-NMR、NOE以及13C、15N、31P的NMR数据对糖链一级结构及其溶液构象的分析,也是必不可少的。对于N-连接的糖链,完备的ID-NMR数据库已经建立,并已成功地用于糖肽和糖蛋白上N-糖链的结构分析,最近Wyss等[8]又使用750MHz的核磁谱仪研究了人CD2中粘附域hsCD2105中肽链和糖链的结构,从而使人们首次测定了完整糖蛋白的溶液构象,并由此对其中糖链的作用机制进行了探讨。 2、酶学方法 在以前糖类结构的酶学方法中,人们通常采用的是一些外切糖苷酶对寡糖进行顺序消化以推测其化学结构,由于酶解的高度专一性和放射标记方法的引入使得这种方法十分有效并广为采用。但这种方法最大的缺陷在于酶解结束后需要很多次地进行分离和确定产物的流体动力学体积,试剂阵列分析方法(reagent array analysis method,RAAM)就是针对这种问题应运而生的[9]。它将酶解方法的操作简化为只要将纯化的寡糖样品等分成几个试样,再将每个试样与某种精确设定的外切糖苷酶混合物保温酶解,这种特定酶混合物就叫做试剂阵列(reagent array)。其原理是许多外切糖苷酶的混合物与糖链样品保温酶解,直至所有酶都无法断裂的连接点,称为终点片段("stop point" fragment)。通过省去其中一种或数种不同的外切糖苷酶所得的酶混合物再酶解糖链就会得到不同的终点片段。又因为放射性标记在糖链的还原端,所以检测时只有终点片段具有放射活性,而反应产物中释放的单糖则没有响应,合并每次酶水解的产物,再对产物库(pool of products)进行一次凝胶渗透色谱分离,把分离图谱与计算机数据库中的寡糖链模拟分离图谱进行对照即可确定样品是何种寡糖,根据这一原理,商品化的糖序列仪(glycpseqiemcer)也已被生产出来。但由于糖蛋白上O-连接糖链的高度复杂性和许多连接特异性的糖苷酶无法获得,因而这一方法目前只适用于结构规律较明确的N-糖链。
OBBA 2008/08/18
[size=4][quote]原文由 [B]qinshan1980[/B] 发表: 最近实验室增购仪器帮忙提取、分离、测试有关寡糖的仪器有哪些 领导让我查下 我一时也不知道 着急中 希望大家帮忙[/quote] [/size]请问斑竹究竟是做什么寡糖,毕竟寡糖那么多,果寡糖、木寡糖、低聚半乳糖、低聚异麦芽糖、水苏糖、龙胆糖,还是什么,目前我国主要的就有果寡糖、木寡糖、低聚异麦芽糖、水苏糖,几种,提取的方法需要你自己根据样品的成分来做,寡糖大多数不溶于无水乙醇,测试现在我国几个厂家都在用HPLC,但从国外的一些先进仪器来看,如果经费充足可以用近红外分析仪,离子迁移光谱仪。其中离子迁移光谱仪的分析速度可以提高近7倍,分析下限可以达到ng水平,而且也告别了[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]用乙腈等危险流动相。
liss576 2008/08/22
忘了,再补充一点,呵呵。寡糖一般不溶于90%以上的乙醇。如果用水提醇沉法的话,可以用80%乙醇沉淀,这样沉淀基本为多糖,而上清为寡糖和糖苷类物质。上清浓缩后过大孔树脂就可以了。这样可以避免多糖的干扰。相对方便些。
isomer 2008/08/13
没做过寡糖,不知道是不是分光法检测的。 手上有检测方法吗?
金月 2008/08/13
磷酸寡糖检测方法的研究 Study on the determination of phosphoryl oligosaccharides <<食品工业科技 >>2003年12期 毛跟年 , 张嫱 , 杨亚洲 , 许牡丹 实验结果表明,用展开剂正丁醇:乙酸:水=3:1:1,显色剂苯胺-二苯胺-磷酸,点样量为2μg/μL,点样原点直径小于2mm时,可将麦芽糖至麦芽七糖各组分分开,斑点清晰、圆形、无托尾,分离效果好.土豆淀粉中的磷酸寡糖主要含有麦芽三糖、麦芽四糖、麦芽五糖和麦芽六糖,其中平均每四个葡萄糖残基上连接有一个磷酸根.用碱性磷酸酯酶法测定土豆淀粉中的磷酸寡糖,具有样品回收率高、相对误差较小、方法简便、仪器廉价、准确性好等优点,适合于磷酸寡糖常规检验. 关键词: 磷酸寡糖 , 碱性磷酸酯酶 , TLC法 | 全部关键词
金月
第3楼2008/08/13
摘要:
报道了研究寡糖链对糖蛋白热力学性质影响的新方法;以小麦胚芽为原料,从其水溶性提取物中分离得到粗蛋白-糖复合物,经DEAE_Cellulose52和SephadexG_100柱层析,得到一种糖蛋白(WGGP);采用差示扫描量热法(DSC)分别对WGGP和去糖基化的WGGP的热力学参数进行了测定,二者的tp分别为96.098℃和74.338℃,说明WGGP的寡糖链对于蛋白质具有较好的稳定和抗变性功能。
关键词:
差示扫描量热法;糖蛋白;寡糖链;热力学性质;去糖基化
中图分类号:O657.99;Q513.2
作者:
朱科学,周惠明 ------江南大学食品学院,江苏无锡214036
金月
第4楼2008/08/13
磷酸寡糖检测方法的研究
Study on the determination of phosphoryl oligosaccharides
<<食品工业科技 >>2003年12期
毛跟年 , 张嫱 , 杨亚洲 , 许牡丹
实验结果表明,用展开剂正丁醇:乙酸:水=3:1:1,显色剂苯胺-二苯胺-磷酸,点样量为2μg/μL,点样原点直径小于2mm时,可将麦芽糖至麦芽七糖各组分分开,斑点清晰、圆形、无托尾,分离效果好.土豆淀粉中的磷酸寡糖主要含有麦芽三糖、麦芽四糖、麦芽五糖和麦芽六糖,其中平均每四个葡萄糖残基上连接有一个磷酸根.用碱性磷酸酯酶法测定土豆淀粉中的磷酸寡糖,具有样品回收率高、相对误差较小、方法简便、仪器廉价、准确性好等优点,适合于磷酸寡糖常规检验.
关键词: 磷酸寡糖 , 碱性磷酸酯酶 , TLC法 | 全部关键词
活到九十 学到一百
第5楼2008/08/13
到目前为止,已经建立的寡糖结构分析方法有化学法,如甲基化分析、Smith降解、过碘酸氧化、乙酰解、三氧化铬氧化等;物理方法,包括磁共振波谱(1H,13cNMR)、快原子轰击质谱;以及生物学方法,主要是酶解分析。
因为糖缀合物上的寡糖链在生命过程的重要作用,所以开展寡糖的结构与功能关系研究显得非常重要,在寡糖的分离与分析方面已经有了许多很好的综述,下面只对近年来这方面的研究进展作一简单评述。
寡糖的分离
寡糖链的分离和纯化,是寡糖结构分析的关键环节,寡糖自身在组成、连接、衍生化、外观不均一性等方面的高度复杂性及其检测上的困难,使得寡糖混合物的分离一直困扰着糖化学家,因此选择合适的方法对收集到的混合糖链进行分离,是一项探索性很强的工作。下面就最近几年糖分离手段的主要进展分述如下。
1、石墨化碳柱的高压液相色谱
与糖类高压液相色谱分析中常用的正相反相和阴离子交换柱的分离原理不同的是,石墨化碳柱的保留机制不仅基于填充剂与样品的疏水相相互作用,而且还包括电子受体-供体之间的相互作用。与HPAEC相比,石墨化碳柱(graphitized carbon colamn,GCC)的容量更大,非常适合于寡糖的制备性操作,而且洗脱时只要用易于除去的水溶性有机溶剂即可,再由于糖类分子的强亲水性,通常用ODS柱分离时寡糖分子需要进行衍生化,操作复杂;而GCC柱对非衍生化的寡糖和带有少量氨基酸残基的糖肽都能获得良好的分离效果[1]。
2、高效毛细管电泳
除了少数带有羧基和磺酸基的糖类化合物,绝大多数的糖类化合物不带电荷、极性很大而且没有发色基团或荧光基团,所以用一般的高效毛细管电泳(high performance capillary electmphoresis,HPCE)系统无法得到分离和检测,为了使糖类化合物能产生电迁移而得以相互分离,可采用的方法有:
a.衍生化使之带上发色、荧光基团或电荷;
b.与硼酸盐等络合;
c.与缓冲液中的添加剂形成包合配合物;
d.高pH缓冲条件下使之电离;
e.加入表面活性剂使形成胶囊。
检测则可用:
a.直接紫外或荧光法;
b.间接紫外或荧光法;
c.示差检测法;
d.电流检测法;
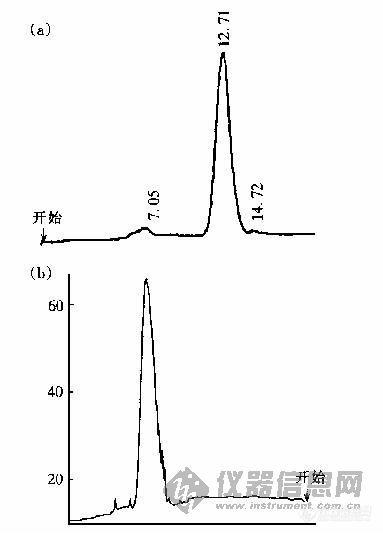
e.质谱法,分离与检测方法的确定则由糖的性质、所存在的介质以及所使用的仪器所决定[2]。如图1是我们利用HPLC和HPCE研究牛膝多糖(Abps)精制品的分离图谱,从两张图谱可以看出在HPLC呈单一对称的主峰(Abps)在HPCE图中可以看出有许多毛刺出现,这就从一个侧面直观地证明了牛膝多糖是一种小分子质量寡糖的同系混合物。
寡糖的结构分析
活到九十 学到一百
第6楼2008/08/13
寡糖的结构分析
到目前为止,已经建立的寡糖结构分析方法有化学法,如甲基化分析、Smith降解、过碘酸氧化、乙酰解、三氧化铬氧化等;物理方法,包括磁共振波谱(1H,13cNMR)、快原子轰击质谱(fast atom bombardment-mass spectroscopy,FABMS);以及生物学方法,主要是酶解分析。而随着现代分析技术的出现与发展,新技术的引入使得糖链的结构分析工作已不再令人生畏。 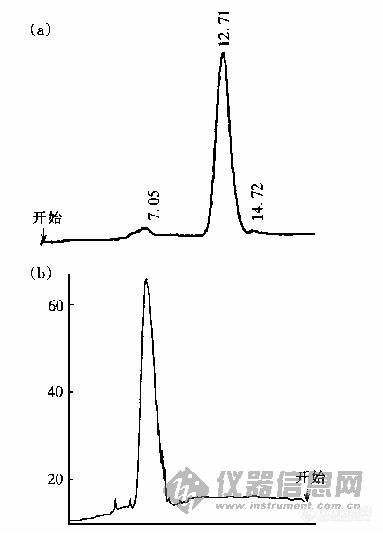
(a)HPLC,色谱柱TSK2000;洗脱液:水;检测器:示差检测器,流速1 0ml/min
(b)HPCE,仪器所内自制,缓冲液0 09mol/LNaOH,电压18kV,检测器:电流检测器,E=+0 65V(vs.饱和甘汞电极),毛细管长90cm
1、物理方法
⑴质谱
在糖类结构研究的众多分析方法中,质谱被认为是很有前途的手段之一,它灵敏度高、结构信息直观,尤其是20世纪80年代出现的FABMS,使得高极性、难挥发而且热不稳定的糖及其缀合物的直接分析成为可能,质谱技术在最近几年来又取得了飞速的发展。
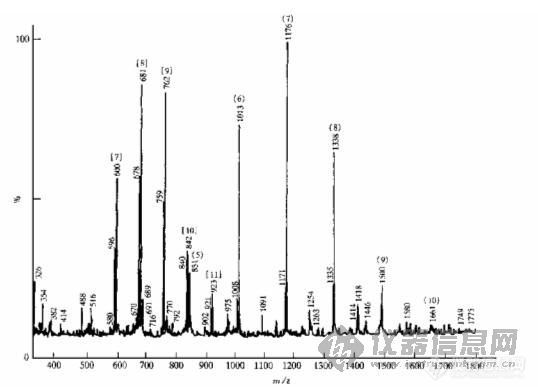
①电喷雾电离质谱:电喷雾电离质谱是将溶液中分子转变成气相离子的非常有效的手段,这样产生的分子离子往往带有多个电荷,这些离子是靠吸附或失去若干个氢而形成的,所以在正离子或负离子谱上会观测到(M+nH)n+或(M-nH)n-的峰,因此就使ESI-MS可以测定的分子质量范围便大大扩展。图2是我们课题组最近测定牛膝多糖4分子质量分布的ESI-MS图谱(徐愿坚,1996),从中可以明显看到牛膝多糖4中不同分子质量寡糖的分布,人们发现由ESI产生的离子的碎片化反应会因异构体的不同而有所差异,所以寡糖及其缀合物于过碘酸氧化、还原、甲基化前后用ESI-CID联用技术可获得不同的碎片离子,由此能够获知pmol级的寡糖及其缀合物的分子质量、序列、分枝和连接信息[3]。
②基质辅助的激光解吸电离质谱:基质辅助的激光解吸电离质谱技术几乎与ESI同时于20世纪80年代末问世,由于技术上的特点,这种离子化方式电离出的离子常用飞行时间(TOF)检测器来检测,所以MALDI常与TOF连在一起称为基质辅助的激光解吸飞行时间质谱仪。它也是一种"软电离"方式,产生的分子离子稳定,不易裂解,适用于测定大分子质量的生物样品。与蛋白质和糖蛋白通常给出强的[M+H]-离子之外还给出较弱的双电荷或多电荷离子不同的是,中性寡糖分子仅给出单一的[M+Na]+离子峰。此外,MALDI方式不受样品中所含添加剂、缓冲液或盐类的影响,其灵敏度也是各类电离方式中最高的[4]。 
图2 牛膝多糖-4的ESI-MS图 括号中数字为寡糖的聚合度,()表示是单电荷分子离子,[]表示是双电荷分子离子
活到九十 学到一百
第7楼2008/08/13
⑵电泳
①毛细管电泳(CE): 毛细管利用它进行寡糖的组成分析、纯度鉴定和结构电泳不仅仅是一种分离手段,糖化学家还可以归属[5]。它既可以对复杂寡糖进行直接分析,得到寡糖的微观不均一性的信息,又可以对寡糖的酶解产物进行定性和定量分析,从而得出寡糖链的完整结构。
②SDS-PAGE-PVDF技术:利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳-聚偏氟乙烯薄膜电迁移技术[6]可以把电泳凝胶上的糖蛋白基本上定量地转移到聚偏氟乙烯薄膜上,在此膜上可以直接进行酸水解,然后分析其氨基酸和糖基组成;也可以在此膜上进行溴化氰降解、各种蛋白酶、糖肽酶和糖苷酶水解,以及把PVDF膜直接置于蛋白质气相序列仪或质谱上进行序列分析,从而获得pmol级糖蛋白的肽链和糖链结构以及糖肽连接方式,其做法是首先将转移到PVDF膜上的蛋白质剪下,溶解后分成数个试样,再用酸水解确定所研究的蛋白质是否含有糖基和含有什么样的单糖组成,若是糖蛋白则可用糖苷酶,如PNGase、Endo H、Endo F2等对其进行酶解,又用HPAEC-PAD分析所得的寡糖链,从而推测出糖蛋白上的糖链结构。
③荧光基团辅助的糖电泳[7]:荧光基团辅助的糖电泳,又称荧光基团标记的糖的聚丙烯酰胺凝胶电泳,是一种寡糖结构分析的简便方法。它可以用来对多个样品平行地进行寡糖样品的简单、快速、灵敏和高分辨率的分离及定量分析。它是通过对糖类分子的还原端羰基进行荧光基团衍生化标记后进行聚丙烯酰胺凝胶电泳,这既增强了寡糖分子的检测灵敏度(<10~12 mol),又使通常呈中性的糖类分子带上电荷在电泳体系中进行分离。荧光试剂主要有两种:8-氨基萘基-1,3,6-三磺酸和2-氨基吖啶酮。分别用于中性与酸性寡糖的分离。因为疑胶电泳可以很方便地使用通常所用的蛋白质疑胶电泳设备和缓冲液体系(只要把沉淀剂SDS省去即可),而且在一次电泳时可以平行地进行多个寡糖样品的对照分离,所以它与酶解方法结合能非常方便、快捷和灵敏地对寡糖进行结构分析,这种方法与前面的CE方法有着异曲同工之妙,但所需仪器设备却更为简便。
⑶磁共振方法
NMR技术对寡糖及其糖肽结构研究工作具有举足轻重的作用。尽管糖链中氢谱重叠十分严重,但500MHz或600MHz的高分辨1H-NMR能准确测定结构表征基团(structure reporter groups)的化学位移和峰宽,精度可达0.001。糖链的各种结构特征,均可由这些结构表征基团的微小位移变化出来,此外2D-NMR、NOE以及13C、15N、31P的NMR数据对糖链一级结构及其溶液构象的分析,也是必不可少的。对于N-连接的糖链,完备的ID-NMR数据库已经建立,并已成功地用于糖肽和糖蛋白上N-糖链的结构分析,最近Wyss等[8]又使用750MHz的核磁谱仪研究了人CD2中粘附域hsCD2105中肽链和糖链的结构,从而使人们首次测定了完整糖蛋白的溶液构象,并由此对其中糖链的作用机制进行了探讨。
2、酶学方法
在以前糖类结构的酶学方法中,人们通常采用的是一些外切糖苷酶对寡糖进行顺序消化以推测其化学结构,由于酶解的高度专一性和放射标记方法的引入使得这种方法十分有效并广为采用。但这种方法最大的缺陷在于酶解结束后需要很多次地进行分离和确定产物的流体动力学体积,试剂阵列分析方法(reagent array analysis method,RAAM)就是针对这种问题应运而生的[9]。它将酶解方法的操作简化为只要将纯化的寡糖样品等分成几个试样,再将每个试样与某种精确设定的外切糖苷酶混合物保温酶解,这种特定酶混合物就叫做试剂阵列(reagent array)。其原理是许多外切糖苷酶的混合物与糖链样品保温酶解,直至所有酶都无法断裂的连接点,称为终点片段("stop point" fragment)。通过省去其中一种或数种不同的外切糖苷酶所得的酶混合物再酶解糖链就会得到不同的终点片段。又因为放射性标记在糖链的还原端,所以检测时只有终点片段具有放射活性,而反应产物中释放的单糖则没有响应,合并每次酶水解的产物,再对产物库(pool of products)进行一次凝胶渗透色谱分离,把分离图谱与计算机数据库中的寡糖链模拟分离图谱进行对照即可确定样品是何种寡糖,根据这一原理,商品化的糖序列仪(glycpseqiemcer)也已被生产出来。但由于糖蛋白上O-连接糖链的高度复杂性和许多连接特异性的糖苷酶无法获得,因而这一方法目前只适用于结构规律较明确的N-糖链。
OBBA
第10楼2008/08/18
希望您不懂不要从别的地方找来一些东西往上面瞎贴,你知道什么是寡糖吗,你就搞出来一些结构上的东西贴!!!!