

平凡人
第1楼2009/09/24
3 分析化学发展简史
分析化学历史悠久
无机定性分析曾一度是化学科学的前沿
公元一世纪橡子提取物检验铁
十七世纪Boyle将石蕊作酸碱指示剂
1751年Margraf 硫氰酸盐检验Fe(III)
分析化学发展经历3次重大变革
第一个重要阶段:
20世纪起初的20-30年间分析化学发展成为一门独立的学科
物理化学的溶液理论发展,推动化学分析快速发展
用物理化学中的溶液平衡理论、动力学等研究分析化学中的基本理论问题:沉淀的形成和共沉淀;指示剂变色原理;滴定曲线和终点误差;缓冲原理及催化和诱导反应等。建立了溶液中四大平衡理论。
第二个重要阶段:
20世纪40年代,仪器分析的发展。
分析化学与物理学及电子学结合的时代。
原子能和半导体技术兴起,如要求超纯材料,99.99999%,砷化镓,要测定其杂质,化学分析法无法解决,促进了仪器分析和各种分离方法的发展。
第三个重要阶段:
20世纪70年代以来, 分析化学发展到分析科学阶段
现代分析化学把化学与数学、物理学、计算机科学、精密仪器制造、生命科学、材料科学等学科结合起来,成为一门多学科性的综合科学。
平凡人
第2楼2009/09/24
4 分析化学发展趋向
高灵敏度――单分子(原子)检测
高选择性――复杂体系(如生命体系、中药)
原位、活体、实时、无损分析
自动化、智能化、微型化、图像化
高通量、高分析速度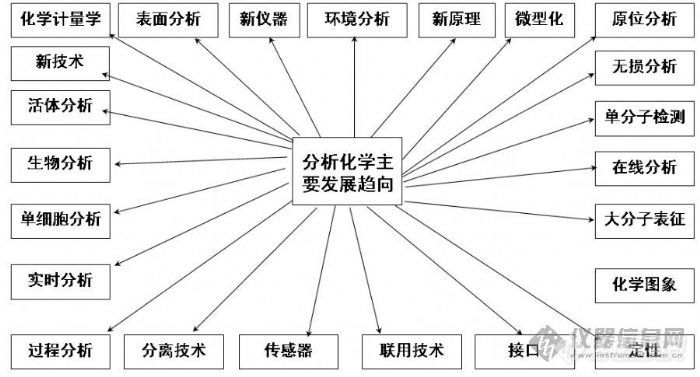
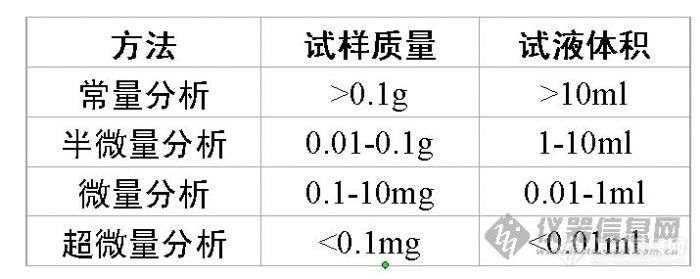
1.2 定量分析化学概论
定量分析化学中的基本工具、专业名词
定量分析的操作步骤
经典定量分析方法-化学分析
1 定量分析的操作步骤
1) 取样
2) 试样分解和分析试液的制备
3) 分离及测定
4) 分析结果的计算和评价
2 经典定量分析方法
重量法: 分离 称重
沉淀法、气化法和电解法等
滴定分析法:又称容量分析法
酸碱滴定法、 络合滴定法
氧化还原滴定法、沉淀滴定法
1.3 滴定分析法概论
1 滴定分析法:又称容量分析法。
标准溶液
化学计量关系 指示剂
被测物质
酸碱滴定法、 络合滴定法
氧化还原滴定法、沉淀滴定法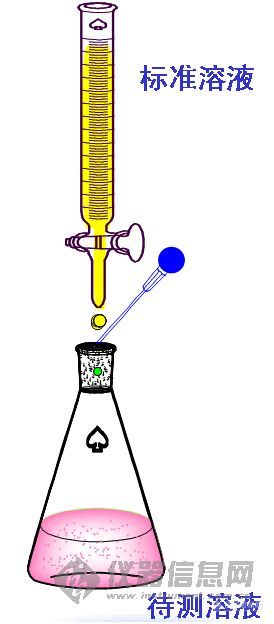
2 滴定分析法对化学反应的要求
有确定的化学计量关系,反应按一定的反应方程式进行
反应要定量进行
反应速度较快
容易确定滴定终点
平凡人
第3楼2009/09/24
3 滴定方式
a.直接滴定法
b.间接滴定法
如Ca2+沉淀为CaC2O4,再用硫酸溶解,用KMnO4滴定C2O42-,间接测定Ca2+
c.返滴定法
如测定CaCO3,加入过量盐酸,多余盐酸用标准氢氧化钠溶液返滴
d.置换滴定法
络合滴定多用
4 基准物质和标准溶液
基准物质: 能用于直接配制和标定标准溶液的物质。
要求:试剂与化学组成一致;纯度高;稳定;摩尔质量大;滴定反应时无副反应。
标准溶液: 已知准确浓度的试剂溶液。
配制方法有直接配制和标定两种。
标准溶液浓度计算
a. 直接配制法
称一定量的基准物质B(mB g)直接溶于一定量(V L)的溶剂配制。
cB=nB/V=mB/MBV
b 标定法:
根据滴定剂和被测物质的比计算求出。
bB+tT=aA
cB=b/t · cT·VT/VB
=bmT/tMT VB