

实训一 氢氧化钠标准溶液的配制和标定
lilongfei14
第1楼2011/10/20
四、操作步骤
1. 0.1mol/L NaOH标准溶液的配制
用小烧杯在台秤上称取120g固体NaOH,加100mL水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。
准确吸取上述溶液的上层清液5.6mL到1000毫升无二氧化碳的蒸馏水中,摇匀,贴上标签。
2. 0.1mol/L NaOH标准溶液的标定
将基准邻苯二甲酸氢钾加入干燥的称量瓶内,于105-110℃烘至恒重,用减量法准确称取邻苯二甲酸氢钾约0.6000克,置于250 mL锥形瓶中,加50 mL无CO2蒸馏水,温热使之溶解,冷却,加酚酞指示剂2-3滴,用欲标定的0.1mol/L NaOH溶液滴定,直到溶液呈粉红色,半分钟不褪色。同时做空白试验。
要求做三个平行样品。
五、结果结算
NaOH标准溶液浓度计算公式:
m
CNaOH =
(V1-V2)× 0.2042
式中:m---邻苯二甲酸氢钾的质量,g
V1---氢氧化钠标准滴定溶液用量,mL
V2---空白试验中氢氧化钠标准滴定溶液用量,mL
0.2042---与1mmol氢氧化钠标准滴定溶液相当的基准邻苯二甲酸氢钾的质量,g
思考题
lilongfei14
第2楼2011/10/20
实训二 盐酸标准溶液的配制和标定
Na2CO3 + 2HCl 2NaCl + CO2 + H2O
思 考 题
lilongfei14
第3楼2011/10/20
实训三 EDTA标准溶液的配制和标定
lilongfei14
第4楼2011/10/20
四、步骤
1. 0.01mol·L-1EDTA溶液的配制
称取乙二胺四乙酸二钠盐(Na2H2Y·2H2O)4g,加入1000mL水,加热使之溶解,冷却后摇匀,如混浊应过滤后使用。置于玻璃瓶中,避免与橡皮塞、橡皮管接触。贴上标签。
2. 锌标准溶液的配制
准确称取约0.16g于800℃灼烧至恒量的基准ZnO,置于小烧杯中,加入0.4mL盐酸,溶解后移入200mL容量瓶,加水稀释至刻度,混匀。
3. EDTA溶液浓度的标定
吸取30.00~35.00mL锌标准溶液于250mL锥形瓶中,加入70mL水,用40%氨水中和至pH为7~8,再加10mL氨水-氯化铵缓冲液(pH=10),加入少许铬黑T指示剂,用配好的EDTA溶液滴定至溶液自紫色转变为纯蓝色。记下所消耗的EDTA溶液的体积,根据消耗的EDTA溶液的体积,计算其浓度。
思 考 题
lilongfei14
第5楼2011/10/20
实训四 硫代硫酸钠标准溶液的配制和标定
一、实训目的
1、掌握硫代硫酸钠标准滴定溶液的配制、标定和保存方法。
2、掌握以碘酸钾为基准物间接碘量法标定硫代硫酸钠的基本原理、反应条件、操作方法和计算。
二、实训原理
Na2S2O3·5H2O容易风化、潮解,且易受空气和微生物的作用而分解,因此不能直接配制成准确浓度的溶液。但其在微碱性的溶液中较稳定。当标准溶液配制后亦要妥善保存。
标定Na2S2O3溶液通常是选用KIO3、KBrO3或K2Cr2O7等氧化剂作为基准物,定量地将I— 氧化为I2,再用Na2S2O3溶液滴定,其反应如下;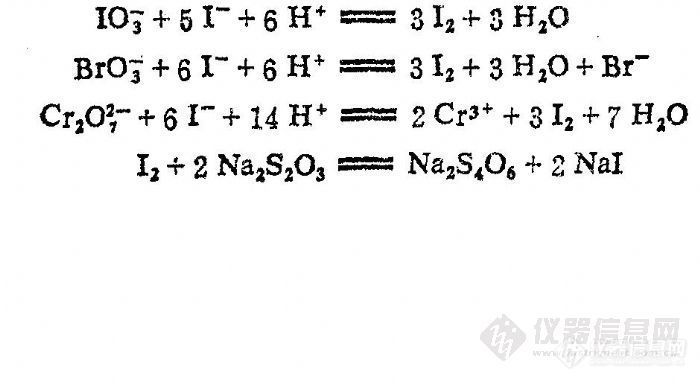
上述几种基准物中一般使用KIO3和KBrO3较多,因为不会污染环境。
三、试剂
1、基准试剂 KIO3;
2、20%KI溶液;
3、0.5 mol/LH2SO4溶液;
4、5g/L淀粉溶液:0.5g可溶性淀粉放入小烧杯中,加水10mL,使成糊状,在搅拌下倒入90 mL沸水中,继续微沸2min,冷却后转移至试剂瓶中。
lilongfei14
第6楼2011/10/20
实训四 硫代硫酸钠标准溶液的配制和标定
一、实训目的
1、掌握硫代硫酸钠标准滴定溶液的配制、标定和保存方法。
2、掌握以碘酸钾为基准物间接碘量法标定硫代硫酸钠的基本原理、反应条件、操作方法和计算。
二、实训原理
Na2S2O3·5H2O容易风化、潮解,且易受空气和微生物的作用而分解,因此不能直接配制成准确浓度的溶液。但其在微碱性的溶液中较稳定。当标准溶液配制后亦要妥善保存。
标定Na2S2O3溶液通常是选用KIO3、KBrO3或K2Cr2O7等氧化剂作为基准物,定量地将I— 氧化为I2,再用Na2S2O3溶液滴定,其反应如下;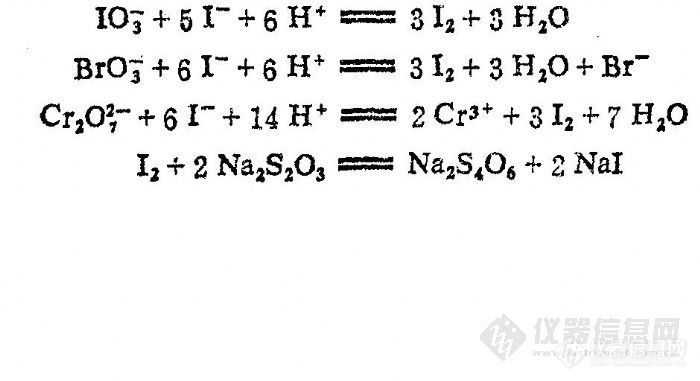
上述几种基准物中一般使用KIO3和KBrO3较多,因为不会污染环境。
三、试剂
1、基准试剂 KIO3;
2、20%KI溶液;
3、0.5 mol/LH2SO4溶液;
4、5g/L淀粉溶液:0.5g可溶性淀粉放入小烧杯中,加水10mL,使成糊状,在搅拌下倒入90 mL沸水中,继续微沸2min,冷却后转移至试剂瓶中。
lilongfei14
第7楼2011/10/20
四、实训步骤
1、0.l mol/L Na2S2O3标准溶液的配制
称取13克Na2S2O3·5H2O置于400 mL烧怀中,加入200 mL新煮沸的冷却的蒸馏水,待完全溶解后,加入 0.1g Na2CO3,然后用新煮沸经冷却的蒸馏水稀释至500 mL,保存于棕色瓶中,在暗处放置 7—14天后标定;
2、Na2S2O3标准溶液的标定
准确称取基准试剂 KIO3约0.9克于 250 mL烧杯中,加入少量蒸馏水溶解后,移入 250 mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
用移液管吸取上述KIO3标准溶液25 mL置于250mL锥形瓶中,加入KI溶液5 mL和H2SO4溶液5 mL,以水稀释至100mL,立即用待标定的Na2S2O3溶液滴定至淡黄色;再加入5 mL淀粉溶液,继续用Na2S2O3溶液滴定至蓝色恰好消失,即为终点。根据消耗的Na2S2O3溶液的毫升数及 KIO3的量,计算 Na2S2O3溶液的准确浓度。
若选用KBrO3作基准物时其反应较慢,为加速反应需增加酸度,因而改为取1mol/LH2SO4溶液溶液5mL,井需在暗处放置5 min,使反应进行完全,并且改用碘量瓶。
注意事项
1、配制Na2S2O3溶液时,需要用新煮沸(除去CO2和杀死细菌)并冷却了的蒸馏水,或将Na2S2O3试剂溶于蒸馏水中,煮沸10min后冷却,加入少量Na2CO3使溶液呈碱性,以抑制细菌生长。
2、配好的Na2S2O3溶液贮存于棕色试剂瓶中,放置两周后进行标定。硫代硫酸钠标准溶液不宜长期贮存,使用一段时间后要重新标定,如果发现溶液变浑浊或析出硫,应过滤后重新标定,或弃去再重新配制溶液。
3、用Na2S2O3滴定生成I2时应保持溶液呈中性或弱酸性。所以常在滴定前用蒸馏水稀释,降低酸度。用基准物K2Cr2O7标定时,通过稀释,还可以减少Cr3+绿色对终点的影响。
4、滴定至终点后,经过5~10min,溶液又会出现蓝色,这是由于空气氧化I-所引起的,属正常现象。若滴定到终点后,很快又转变为I2一淀粉的蓝色,则可能是由于酸度不足或放置时间不够使KBrO3或K2Cr2O7与KI的反应未完全,此时应弃去重做。
五、结果计算
Na2S2O3标准滴定溶液浓度按下式计算:
6m(KIO3) ×25/250
C(Na2S2O3) =
M(KIO3)V(Na2S2O3)×10-3
思考题
lilongfei14
第8楼2011/10/20
实训五 碘标准滴定溶液的配制与标定
一、实训目的
1、掌握碘标准滴定溶液的配制和保存方法。
2、掌握碘标准滴定溶液的标定方法、基本原理、反应条件、操作步骤和计算。
二、实训原理
碘可以通过升华法制得纯试剂,但因其升华及对天平有腐蚀性,故不宜用直接法配制I2标准溶液而采用间接法。
可以用基准物质As2O3来标定I2溶液。As2O3难溶于水,可溶于碱溶液中,与NaOH反应生成亚砷酸钠,用I2溶液进行滴定。反应式为;
该反应为可逆反应,在中性或微碱性溶液中(pH约为8),反应能定量地向右进行,可加固体NaHCO3以中和反应生成的H+,保持pH在8左右。
由于 As2O3为剧毒物,实际工作中常用已知浓度的硫代硫酸钠标准滴定溶液标定碘溶液(用Na2S2O3标准溶液“比较I2”),即用I2溶液滴定一定体积的Na2S2O3标准溶液。反应为:
以淀粉为指示剂,终点由无色到蓝色。
三、试剂
l. 固体试剂I2(分析纯)。
2.固体试剂KI(分析纯)。
3.淀粉指示液(5g/L)。
4. 硫代硫酸钠标准滴定溶液(0.l mol/L)。
lilongfei14
第9楼2011/10/20
四、实训步骤
1、碘溶液的配制
配制浓度为0.05mol/L的碘溶液 500mL:称取 6.5g碘放于小烧杯中,再称取 17g KI,准备蒸馏水500mL,将KI分4~5次放入装有碘的小烧杯中,每次加水5~10mL,用玻璃棒轻轻研磨,使碘逐渐溶解,溶解部分转入棕色试剂瓶中,如此反复直至碘片全部溶解为止。用水多次清洗烧杯并转入试剂瓶中,剩余的水全部加入试剂瓶中稀释,盖好瓶盖,摇匀,待标定。
2、碘溶液的标定(用Na2S2O3标准溶液“比较”)
用移液管移取已知浓度的Na2S2O3标准溶液25mL于锥形瓶中,加水25mL,加5mL淀粉溶液,以待标定的碘溶液滴定至溶液呈稳定的蓝色为终点。记录消耗 I2 标准滴定溶液的体积V2。
五、数据处理
碘标准滴定溶液浓度按下式计算:
思考题

lilongfei14
第10楼2011/10/21
实训六 高锰酸钾标准溶液的配制和标定
一、实训目的
1、掌握高锰酸钾标准滴定溶液的配制、标定和保存方法。
2、掌握以草酸钠为基准物标定高锰酸钾的基本原理、反应条件、操作方法和计算。
二、实训原理
高锰酸钾(KMnO4)为强氧化剂,易和水中的有机物和空气中的尘埃等还原性物质作用;KMnO4溶液还能自行分解,见光时分解更快,因此KMnO4标准溶液的浓度容易改变,必须正确地配制和保存。
KMnO4溶液的标定常采用草酸钠(Na2C2O4)作基准物,因为Na2C2O4不含结晶水,容易精制,操作简便。KMnO4和Na2C2O4反应如下:
滴定温度控制在70~80℃,不应低于60℃,否则反应速度太慢,但温度太高,草酸又将分解。
三、试剂
1、基准试剂 Na2C2O4;
2、3 mol/LH2SO4溶液;