离子液体萃取-火焰原子吸收法测定复杂体系样品中的锌
摘要:建立了双硫腙鳌合-离子液体(1-A-3-B咪唑六氟磷酸盐)萃取体系,通过火焰原子吸收法测定复杂体系样品中的Zn2+。考察了体系pH值、Zn2+与双硫腙的最佳反应摩尔比、反应温度等萃取条件、Zn2+的反萃条件等影响因素。用该体系方法测定了药物硫酸锌口服液中Zn2+的含量。实验结果表明,Zn2+的浓度在0.05μg/mL-3.0μg/mL范围内,Zn2+的浓度与吸光度成线性关系,线性方程为Abs=0.227096Conc(μg/mL)-0.0035529,线性相关系数r=0.9998,检出限为0.00069μg/mL。与药典中化学法比较,准确度、精密度高,检出限低,缩短了分析时间,且降低了对环境和操作者的危害;与直接火焰原子吸收法比较,避开了SO42-对测定的干扰。该体系方法尤其适用于复杂体系样品中Zn2+的测定,如存在对Zn2+有严重干扰的组分时的测定。
关键词:离子液体;火焰原子吸收光谱法;锌
前言
锌是一种重要的营养元素,很多食品和补锌的药品都含有锌。常用于测定锌的方法有化学分析法、火焰原子吸收光谱法等。化学方法灵敏度低,分析时间长,易对环境和人体造成危害;火焰原子吸收光谱法,灵敏度高,分析时间短,但是复杂样品中的组分常会干扰测定。而且,为了降低检出限和减少基体干扰,上述测定方法中大部分都需要对样品进行预分离富集。这些分离富集方法中最常见的有液/液萃取法,它是一种比较方便简单的分离富集技术,但通常的萃取剂都是易挥发、易燃和有毒的物质,会对人体和环境带来危害。室温离子液体是近年来出现的一种绿色的环保型萃取剂,对环境和操作者的危害小,在分离和富集金属离子方面有重要应用[1,2,3,4]。
本实验以双硫腙为螯合剂, 以离子液体1-A- 3-B咪唑六氟磷酸盐为萃取剂,用火焰原子吸收法测定了复杂体系样品中的Zn2+,建立了当复杂样品中同时存在对Zn2+的测定有严重干扰的组分时,测定Zn2+的一种方法,并测定了药物硫酸锌口服液中Zn2+的含量。
1 实验部分
1.1 实验试剂
1-A-3-B咪唑六氟磷酸盐(纯度≥99%);锌储备液(1000μg/mL),锌浓度为0.1μg/mL,0.2μg/mL,0.4μg/mL,0.8μg/mL,2.0μg/mL的锌标准系列溶液;双硫腙的乙醇溶液(12.3×10-5mol/L);乙酸-乙酸钠缓冲液(pH4.0-X.5);其他试剂均为分析纯,水为二次蒸馏水。
1.2 实验仪器
U-3010紫外可见分光光度计;sarturios分析天平;80-1离心机;岛津AA-6200原子吸收分光光度计;多转速振荡器。

1.3 实验方法
在50mL的锥形瓶中依次加入锌工作液、双硫腙工作液,并加入适量的乙酸-乙酸钠缓冲溶液调节 pH,振荡,使金属离子与双硫腙反应完全,然后加入室温离子液体(1-A-3-B咪唑六氟磷酸盐),震荡,离心收集下层离子液体相,多次加酸反洗离子液体相,合并反洗后的水相,用火焰原子吸收法测定锌浓度。
双硫腙萃取锌离子并用酸溶液反洗后的锌回收率的计算:
回收率P(%)=C1V1/(C0V0)×100%
其中:
C0--原始锌工作液浓度,μg/mL;
V0--原始锌工作液体积,mL;
C1 --加酸反洗后收集的上层酸洗液锌含量,μg/mL;
V1 --加酸反洗后收集的上层酸洗液总体积,mL。
2 结果与讨论
2.1 最佳萃取条件的选择
2.1.1反应体系最佳pH值的选择
用紫外-可见分光光度计扫描双硫腙以及锌-双硫腙鳌合物的最大吸收峰,确定反应体系最佳pH。双硫腙最大吸收峰,λ1=440nm,λ2=596nm。
调节反应体系pH为:1# pH为2.5,2# pH为4.0,,3# pH为4.4,4# pH为5.5,5 # pH为6.5,6 # pH为8.0,7 # pH为9.5,振荡反应10min后,测定吸光度,见图1、图2。
pH在4.0-5.5之间时,吸光度较大,最大吸收波长均为516nm,且螯合物红色现象最明显;7份溶液分别放置10min、20min和30min后,pH在4.0-5.5之间的溶液,体系稳定性最好。pH为8.0-9.5时,吸光度最大,但是最大吸收波长有波动,且此时螯合物红色现象不明显,实际螯合物以双硫腙-水合Zn2+的形式存在,此时更易进入水相,较难被实验用的疏水性离子液体萃取。因此, 锌与双硫腙最佳反应pH为C-D,波长Enm。
2.1.2锌与双硫腙的最佳反应摩尔比
采用摩尔比法测定配合物的组成。锌标准溶液和一系列不同量的双硫腙溶液,调节pH为F, Enm处测吸光度。以吸光度为纵坐标,金属离子与双硫腙的摩尔比为横坐标作一条曲线,曲线的转折点即为最佳摩尔比,结果为1:2。
2.1.3反应物的加入顺序
改变锌标准溶液、缓冲溶液、双硫腙溶液的加入顺序,反应后测定螯合物的吸光度,得最佳加入顺序为,先加双硫腙溶液,再加缓冲溶液,最后加锌标准溶液。
2.1.4最佳反应温度
在2.1.1、2.1.2、2.1.3和2.1.4的实验条件下,考察了反应温度(5℃、10℃、20℃、30℃、40℃)对反应的影响。结果表明,最佳反应温度为20℃。
2.1.5振荡条件
在2.1.1、2.1.2、2.1.3、2.1.4和2.1.5的实验条件下,考察了振荡条件(转速、反应时间)对反应的影响。低速震荡,反应效果较好;随着反应时间的增加,螯合物的吸光度先增加后减小,反应20min时,反应最充分。故最佳反应震荡条件为低速振荡、反应20min。
2.1.6萃取剂离子液体用量
在2.1.1、2.1.2、2.1.3、2.1.4和2.1.5的实验条件下,按照1.3实验方法,考察了离子液体用量,平行4次,结果见表1。
表1离子液体用量对锌的萃取率的影响
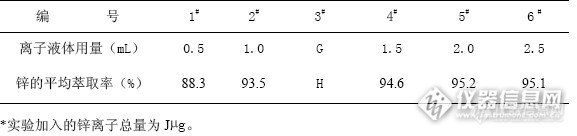
离子液体最佳用量为GmL。
2.2 锌的反萃方法
2.2.1反洗用酸的选择
在2.1最佳实验条件下,按照1.3方法实验,试验离心后的下层离子液体相用反洗用酸的选择(种类、浓度)。经过实验,硝酸比盐酸、硫酸的效果好。分别取5mL 、浓度为4%、6%、8%、10%、14%的硝酸加入离子液体相,振荡5分钟,离心,测定上层酸洗液的锌含量,计算酸洗一次后的反萃取率,结果见表2。
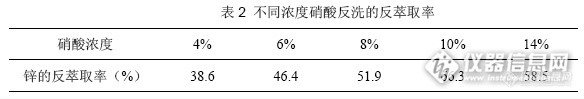
锌的反萃取率先增大后减小,当用10%的硝酸反洗时,反萃取率最大,故选用10%硝酸。
2.2.2反洗用硝酸用量的选择
分别用10%硝酸反洗,考察反洗用酸的量和反洗次数,最后测定并计算反萃取率,平行5次,结果见表3。
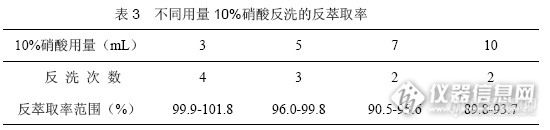
从表3可知,每次用3mL10%硝酸对锌反洗三次可以使反萃取率最高,且消耗酸量最少。
2.3共存离子(物质)的影响
考察了常见离子的干扰。k+、Na+、Mg2+(﹤450倍)无干扰;Cl-、NO3-、SO42-、CO32-(﹤1000倍)无干扰;Cr(Ⅵ)、Ag+(﹤100倍)无干扰;柠檬酸、草酸,酒石酸、蔗糖(﹤15倍)无干扰。
2.4离子液体的回收利用
回收的离子液体颜色呈红色,用10%硝酸洗三次后,恢复离子液体原来的颜色。收集反洗后的离子液体,加入10%氢氧化钠溶液煮沸,回收剩下的离子液体。将回收的离子液体,萃取锌,萃取效果与未用过的离子液体比,第二次实验可达到90%以上的效果。


2.5 应用实例—硫酸锌口服液的测定
2.5.1直接测定锌的影响因素
硫酸锌口服液中硫酸锌含量为(0.2±0.02)g/100mL,另外还含少量的蔗糖、柠檬酸和苯甲酸钠。火焰原子吸收法测定Zn2+时,SO42-存在时严重干扰测定。
为了考察SO42-的存在对Zn2+时测定时干扰,分别用硫酸锌和氯化锌配制了系列浓度一样的标准溶液,Zn2+浓度分别为0.1μg/ mL、0.2μg/ mL、0.4μg/ mL、0.8μg/ mL、2μg/ mL。用硫酸锌配制的Zn2+标准溶液,线性方程为Abs=0.16377Conc-0.0050445,线性相关系数r=0.9997;用氯化锌配制的Zn2+标准溶液,线性方程为Abs=0.227096Conc-0.0035529,线性相关系数r=0.9998。分别用两种试剂配制的、同样浓度的Zn2+标准溶液,测定的吸光度差别很大,以 0.4μg/ mL Zn2+为例,前者为0.0553,后者为0.1910,可见直接测定时,SO42-严重干扰Zn2+测定。
为了考察硫酸锌口服液里的蔗糖、柠檬酸和苯甲酸钠对Zn2+测定的影响,分别取4mL硫酸锌口服液实验,前者用浓硝酸在电热板上消解处理后测定,后者直接按照实验方法测定,平行五份。实验结果表明,两种方法的实验结果无显著性差异,且均符合理论值。所以硫酸锌口服液直接按照实验方法测定,不需要消解。
2.5.2硫酸锌口服液的测定
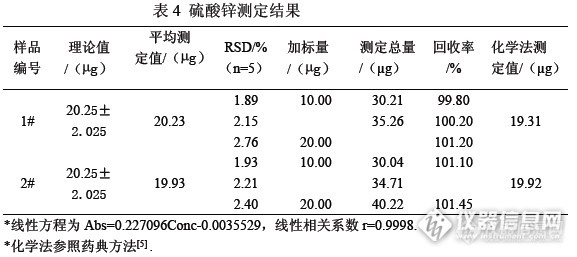
取两个批次的硫酸锌口服液试验。取1mL硫酸锌口服液,定容为200mL。以稀释后的硫酸锌口服液溶液测定为考察对象,分别取稀释后的硫酸锌口服液溶液5mL,按照1.3方法实验,测定19份空白溶液,得到检出限为0.00069μg/mL,实验结果见表4。

3 结论
3.1 与药典方法比较,准确度、精密度高,检出限低;而且要少配很多试剂,实验过程简单,缩短了分析时间;且1-A-3-B咪唑六氟磷酸盐价格相对便宜,几乎没有挥发,回收后可以多次使用,并没有增加实验成本,且减少了污染,同时降低了操作者患职业病的风险;离子液体用量少,且加入的试剂简单,便于操作。
3.2 与直接火焰原子吸收法比较,SO42-严重干扰Zn2+的测定,如直接测定需将SO42从测定溶液里除去,过程烦琐,易影响实验结果,增加时间成本。
3.3 本实验方法分析时间短,加标回收率范围为98.53%-101.45%,相对标准偏差范围为1.89%-2.76%,检出限为0.00069μg/mL,可用于同时存在对Zn2+的有严重干扰组分时的复杂样品体系中Zn2+的测定,也可借鉴用于测定其他金属。
参考文献(省)









