

wang45695
第4楼2013/11/15
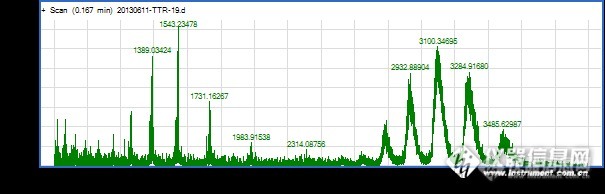
这个蛋白是四聚体蛋白,分子量55kDa, 质谱图中右边是四聚体多电荷峰,保持了主要的生理活性,用于研究蛋白质和小分子配体的结合,左边低质荷比端是蛋白质单体峰,我也用过甲醇或乙腈做流动相,很难得到四聚体蛋白峰,好像都解离为单体了,所以给研究带来了麻烦
!
为了保持蛋白质稳定的四聚体结构才用水做流动相,但离子化效率很低很低,后来我只用0.05%(含醋酸)做流动相,离子化效率稍微增加,但研究蛋白质复合物好像也有问题,因为测了0.05%(含醋酸)的PH为3.45,该条件下蛋白质复合物恐怕已经解离了。
谢谢 chrushcc 的回答,还望指点!