

光谱滴定替代感官滴定进行氢氧化钠标准溶液标定的可行性研究
1、目的:研究光谱滴定替代感官滴定进行氢氧化钠标准溶液标定的可行性
2、验证方法:VSTT技术与人工滴定进行比对。
3、样品前处理方法:称取110g氢氧化钠,溶于100 mL无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。按表1的规定量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000 mL,摇匀。
表1. 氢氧化钠标准溶液的配置
| 待配置的氢氧化钠标准滴定溶液的浓度c(NaOH)/(mol/L) | 氢氧化钠溶液的体积V/mL |
| 1 | 54 |
| 0.5 | 27 |
| 0.1 | 5.4 |
4、测量原理:
4.1、人工滴定测量原理:
人眼睛/传感器接收后,大脑呈现/复原呈颜色。滴定终点为颜色突变点。
4.2、VSTT技术测量原理:
VSTT方法采用同步光谱测量技术还原光谱成分呈现的颜色变化,建立与试剂量关联的色变曲线,以曲线上的信号峰标识滴定终点,实现了分析过程中不依赖人感官感觉的数字化、图形化、可溯源测量技术。
5、氢氧化钠标准滴定溶液的浓度[c(NaOH)]计算公式
氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按式⑴计算:
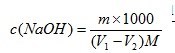
同时做空白。
6、使用的器材、仪器、试剂
光谱滴定仪:SXZ-3型,秦皇岛水熊科技有限公司生产。配备8位自动进样器,光纤光谱仪,400 μm 光纤,AST905接口,配准直透镜,数控搅拌器,自动信号处理系统;光谱范围380 nm~780 nm,△λ5 nm,测量周期200ms,积分时间150 ms,光程10.0 mm,S快+S慢滴定模式,滴定速率0.2 ml/min,搅拌速度400转/min,180 mL靴型反应器。
反应器:150 mL,靴型,石英材质,L=10.0mm, 秦皇岛水熊科技有限公司生产。
器材:按照国家标准《GB/T 5009.1-2003食品卫生检验方法 理化部分 总则》中7的规定,使用的滴定管、移液管、容量瓶、刻度吸管等玻璃量器经按照国家有关规定及规程进行校正,并在有效期内;使用的温度控制设备、测量仪器,均按照按照国家有关规程进行了测试和检定校正。试剂:按照《GB/T5009.1-2003食品卫生检验方法 理化部分 总则》、《GBT 601-2016 化学试剂 标准滴定溶液的制备》和待比对的标准方法中规定的要求制备。
按表2的规定称取于105℃?110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持 30 s同时做空白试验。| 氢氧化钠标准滴定溶液的浓度[c(NaOH)]/(mol/L) | 工作基准试剂邻苯二甲酸氢钾的质量m/g | 无二氧化碳水的体积V/mL |
| 1 | 7.5 | 80 |
| 0.5 | 3.6 | 80 |
| 0.1 | 0.75 | 50 |
7、参加验证人员
******
8、方法学内容:
VSTT与人工感官滴定结果t检验与VSTT滴定参数的选择、检出限、定量限、精密度、准确度、适用范围
9、验证内容与数据
9.1、酚酞性质与变色阈
酚酞(Phenolphthalein),化学分子式:C20H14O4,化学结构式结构式见图1。相对分子质量:318.32,CAS登录号:77-09-8,传统pH变色域值:pH 8.0~pH 10.0(无色→红紫色),易溶于乙醇及碱溶液,不溶于水。
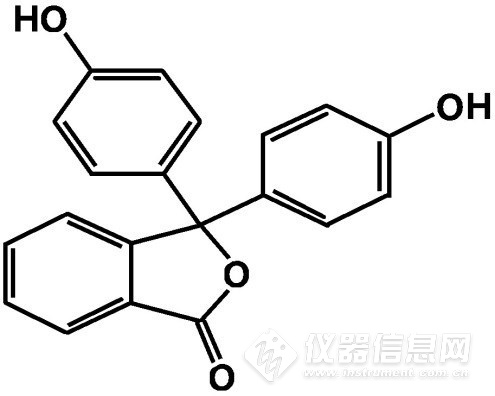
图1.酚酞的化学结构式平面示意图
酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式结构,当pH≥8.2时为红色的醌式结构。在不同的pH环境下,酚酞有不同的分子结构,这就导致其吸收的光谱成分也不同,在其结构改变的临界点,吸收光谱也随之发生变化,该变化点即为滴定终点,见图2。
图2.酚酞的在不同pH条件下的结构变化
在浓度较大的高氯酸、硫酸、磷酸、盐酸等强酸中,由于强酸的催化使酚酞中酯基和指示剂溶剂乙醇中羟基发生酯交换反应,酯基中C-O单键断开生成新酯和新醇,进而在浓酸的作用下发生分子重排,使中心碳原子与相邻苯环上的碳原子脱水形成醌式共轭体系结构,且酸溶液中大量的H+离子与醌式结构中的氧原子结合,加强了吸电子性,使醌式结构中π电子的流动性大大降低,使溶液吸收光谱发生红移,因而溶液呈现棕黄、淡粉色。此变化过程只是分子内部结构发生了重排并形成加合物,从而显示颜色变化,但酚酞的结构未破坏,故其反应是可逆的。
酚酞指示剂在浓的强氧化性酸硝酸(>9 mol/L)中被氧化和硝化,生成绿色硝基化合物,分子结构被破坏,显色反应是不可逆的;而硝酸浓度小于9 mol/L时,不与酚酞反应。
另外,酚酞指示剂用量的多少对它的变色范围是有影响的,如在50 mL~100 mL加2~3滴0.1%酚酞,pH≈9时出现微红,而在相同情况下加入10滴酚酞,则在pH≈8时出现微红[7]。
9.2、酚酞变色曲线
在传统资料中,酚酞变色域值为pH 8.0~pH 10.0(无色→红紫色),没有清晰的pH变色值。采用VSTT技术对酚酞进行测量,可以建立颜色变化曲线,见图3。

图3.酚酞CIE 1976 (L*a*b*)的滴定参数曲线平面坐标图
9.3、VSTT确定滴定终点
VSTT同时还可以建立色变滴定曲线,见图4。从图4中可以的看到,可以利用VSTT技术(参数SJa*-b*),确定含有酚酞为指示剂的滴定终点。VSTT色变点参数曲线SJa*-b*在pH 8.4、pH 13.3两处有明显的色变峰,可以作为滴定终点的指示参数。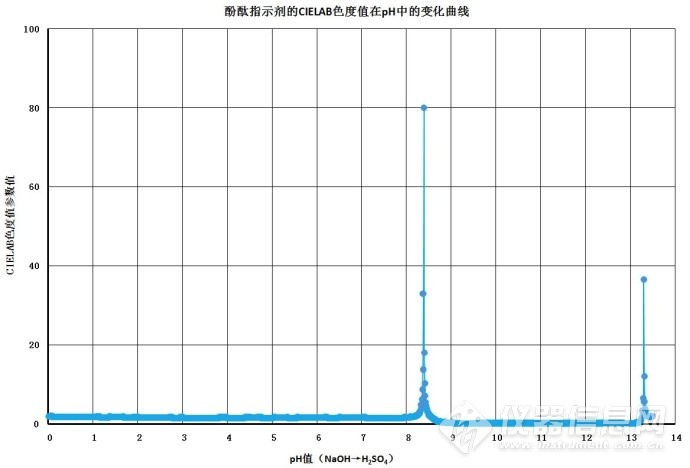
图3.酚酞CIE 1976 (L*a*b*)的滴定参数曲线平面坐标图
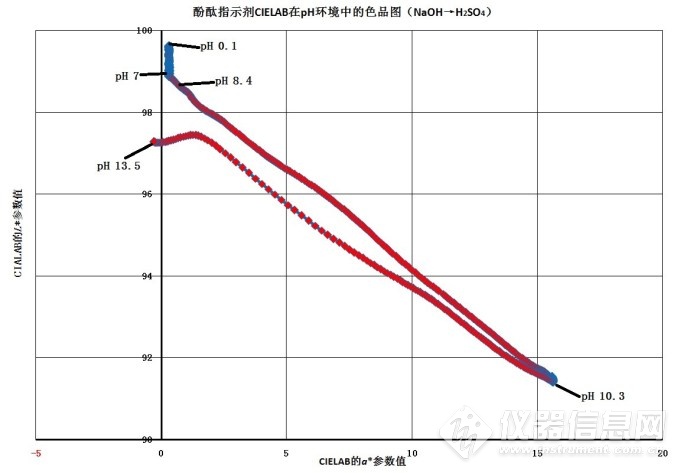
图4-3.酚酞CIE 1976(L*a*b*)的等黄-蓝色品指数b*值的a*-L*色品图
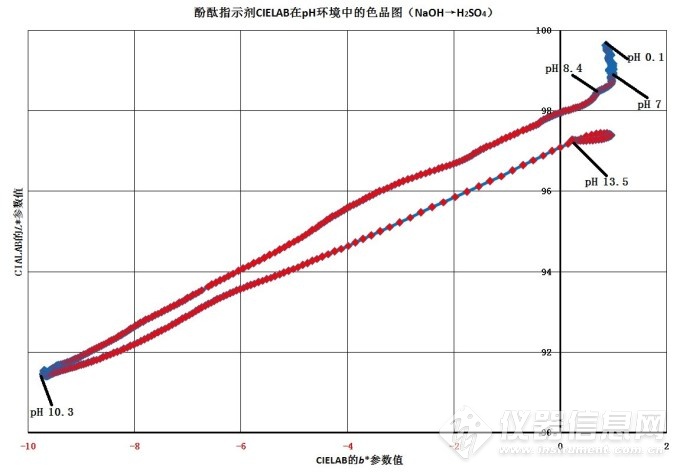
图4-4.酚酞的CIE 1976(L*a*b*)的等红-绿色品指数a*值的b*-L*色品图
图4-2~图4-4表明,.酚酞在不同pH 环境下的CIE 1976(L*a*b*)等明度L*值色品图4-2、等黄-蓝色品指数b*值色品图4-3、等红-绿色品指数a*值色品图4-4的曲线表明,酚酞溶液的pH值在pH 0.1~pH 7.0区间的颜色无变化,pH值在pH 7.0~pH 10.5区间的颜色从无色转为红色和蓝色的混合色紫红色,明度降至最低;pH 10.5~pH 13.5区间的颜色从红色和蓝色的混合色紫红色转为无色透明,明度由暗转明。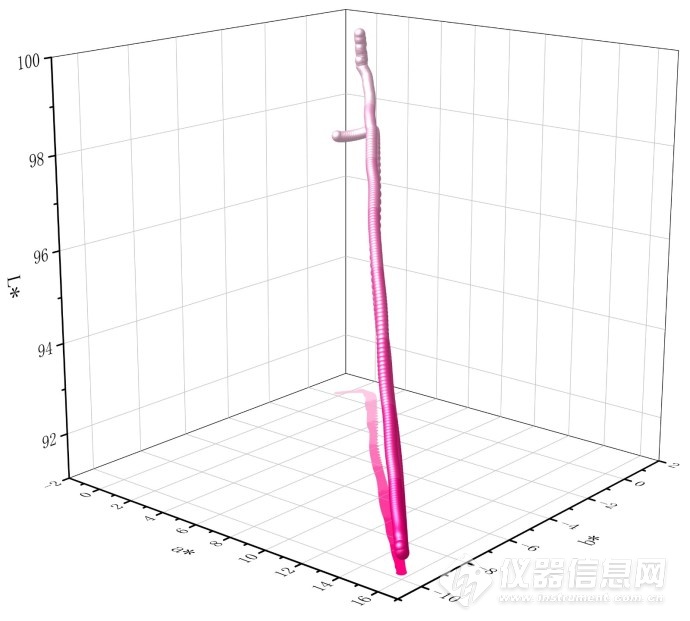
图4-5.酚酞的全pH阈的L*-a*-b*的3维视觉模型滴定曲线图
图4-5中,pH 0.1处的L*值99.63、a*值0.324和b*值0.857,颜色为无色透明;pH 7.0处的L*值98.94、a*值0.328和b*值0.962,颜色为无色透明;pH 8.4处的L*值98.56、a*值0.883和b*值0.828,颜色为粉红色;pH 10.3处的L*值91.87、a*值14.66和b*值-9.063,颜色为深红色;pH 13.5处的L*值97.28、a*值-0.299和b*值0.216,颜色为无色透明。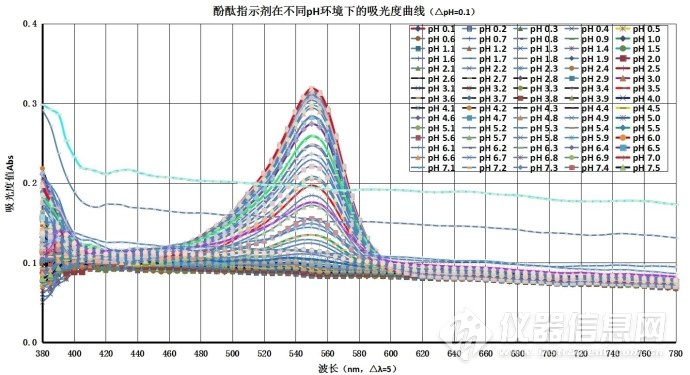
图4-6..酚酞的波长-吸光度曲线(△pH=0.1)
图4-6中的pH1.0~pH8时,在380 nm~780 nm处无吸收峰,颜色为无色;将图4-6中的数据汇总为表,做图为图4-7、4-8。表A.酚酞在不同pH环境下的最大吸收波长的吸光度(△pH =1)
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 550nm | 0.0854 | 0.0871 | 0.0953 | 0.0897 | 0.0922 | 0.0927 | 0.0924 | 0.0936 | 0.1349 | 0.2742 | 0.3150 | 0.3184 | 0.1757 |

图4-7.酚酞在不同pH环境下的最大吸收波长的吸光度(△pH =1)
图4-7中曲线表明,在不同的吸收波长范围的吸光度有所不同。波长为550 nm附近在pH 1.0~pH 8.0范围有近乎相同的吸光度值,波长在pH 8.0~pH 13.5范围吸光度有明显波动,其中从pH 8.0开始至pH 10.0吸光度呈增加趋势,pH 10.0开始至pH 12.0吸光度变化趋势平缓,pH 12.0开始至pH 13.5吸光度呈下降趋势。
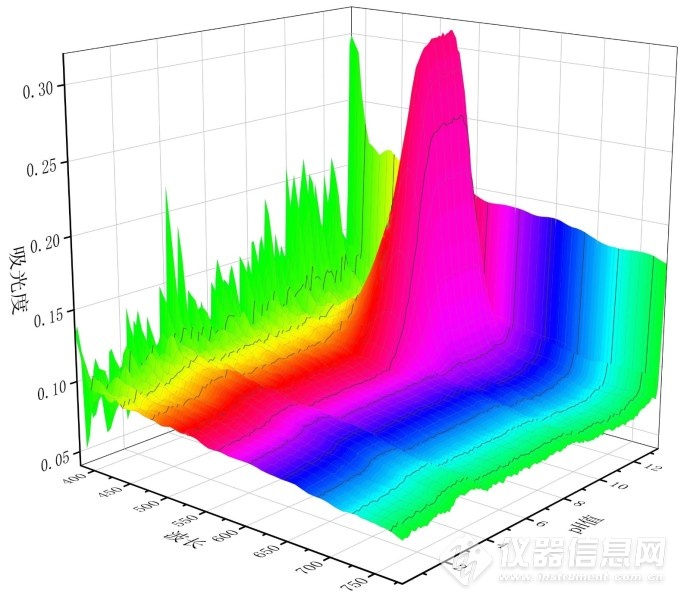
图4-8.酚酞的全pH阈滴定曲线的A-λ-pH的3维视觉模型滴定曲线图
图4-8中酚酞的全pH阈滴定曲线的A-λ-pH的3维视觉模型滴定曲线图峰尖与峰谷表明,最大吸收峰为550 nm附近,从pH 8以后,逐渐出现峰尖,在pH 10.0~pH 12.0区间为峰尖最大值,在pH 12.0附近急剧下降。溶液的颜色紫红色。
9.4、条件实验
9.4.1、VSTT滴定测量原理
在邻苯二甲酸氢钾溶液中加入酚酞乙醇溶液为指示剂,滴加氢氧化钠溶液后。邻苯二甲酸氢钾溶液呈弱酸性,溶液中酚酞呈无色;伴随氢氧化钠溶液的不断加入,溶液逐渐向碱性变化,氢离子浓度变化引起酚酞结构的改变,致使吸收光谱发生了改变,伴随氢氧化钠溶液的不断加入,溶液呈现不同程度的碱性,同时伴随酚酞不同结构的改变,酚酞结构的改变,引起透射的可见光光谱成分被不同程度的吸收。在某一碱性条件,吸收光谱随之发生迅速的而改变,此时被认为是滴定终点,根据滴定终点所消耗氢氧化钠标准溶液的体积量,计算氢氧化钠溶液的含量。
9.4.2、氢氧化钠饱和溶液中碳酸钙的判断方法
取澄清之氢氧化钠饱和液少许,加水稀释,加氢氧化钡饱和液1毫升,十分钟内不产生浑浊,表示碳酸钠已沉淀完全。
9.4.3、氢氧化钠溶液中二氧化碳的影响
氢氧化钠在水溶液中的溶解过程见图1。

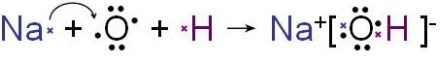
图1.氢氧化钠形成过程的电子式
NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。
氢氧化钠与二氧化碳的反应方程式:
2NaOH+CO2→Na2CO3+H2O
由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。除去Na2CO3最通常的方法是将NaOH先配成过饱和溶液(约52%,W\/W)。由于Na2CO3在过饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来。因此,可用过饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。受空气中二氧化碳的影响,溶液吸收的二氧化碳与氢氧化钠中的某些杂质结合成碳酸盐,由于表面张力的因素,在氢氧化钠溶液表面上有碳酸盐附着。在吸取过饱和氢氧化钠溶液时,要把吸管头插入氢氧化钠溶液液面下约1 cm,并在洗取前排出气泡(利用气泡的逸出将可能粘附在吸管进口表面的碳酸盐推开)。
氢氧化钠的过饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。待Na2CO3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。
9.4.4、标准物质的选择与标定氢氧化钠溶液的原理:
标定碱溶液的基准物质很多,常用的有草酸(H2C2O4?2H2O)、苯甲酸(C6H5COOH)和邻苯二甲酸氢钾(C6H4COOHCOOK)等。
邻苯二甲酸氢钾化学性质稳定,不易挥发,可配成浓度稳定不变的溶液,与氢氧化钠反应定量(生成邻苯二甲酸钾钠和水),因此邻苯二甲酸氢钾适合作为基准物质。同时,邻苯二甲酸氢钾分子量大,这样称取基准物时邻苯二甲酸氢钾的用量大,造成的称量误差小,所以标定后的浓度更准确。反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O
邻苯二甲酸氢钾相当于弱酸,与氢氧化钠反应后生成的产物是邻本二甲酸二钾,若正好中合,则弱酸强碱盐溶液呈碱性。滴定到达终点时,溶液的pH约为9.1。
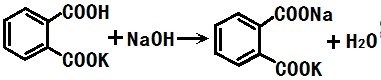
图.氢氧化钠与邻苯二甲酸氢钾反应式
9.4.5、降噪技术的影响
为考察数据处理对测量分析的影响,对溶液进行连续3606次测量值的测量,分别采用不降噪和降噪方式,对实验数据进行处理后。效果分析图见图7-1和图7-2。
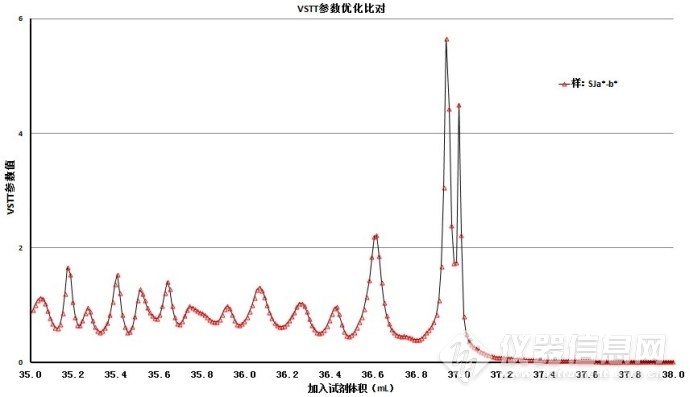
图7-1.未进行降噪的色变曲线滴定终点

图7-2.进行降噪的色变曲线滴定终点
从图7-1和图7-2的比对中明显可以看出,采用未降噪和降噪的滴定终点的信号峰有明显的而不同,降噪后的效果明显。后期实验均进行降噪处理。
9.4.6、VSTT不同参数的不同滴定终点
VSTT可以提供许多色变曲线参数,不同的参数对应与不同的滴定终点,见图5-1~图5-3。与人工标准方法进行比对后,选择结果有较好吻合性的参数为测量用参数。
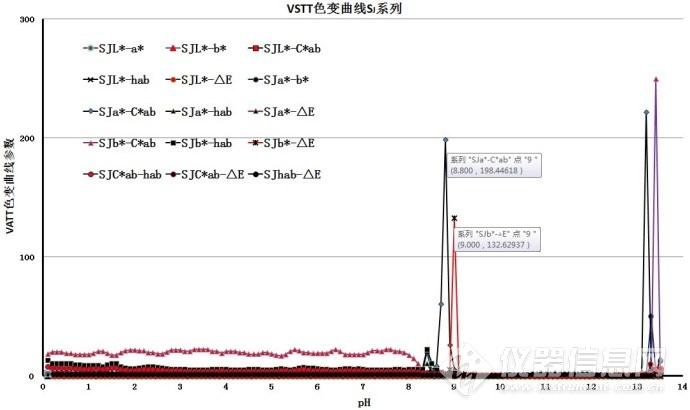
图5-1. VSTT不同参数的滴定终点(全pH阈值)
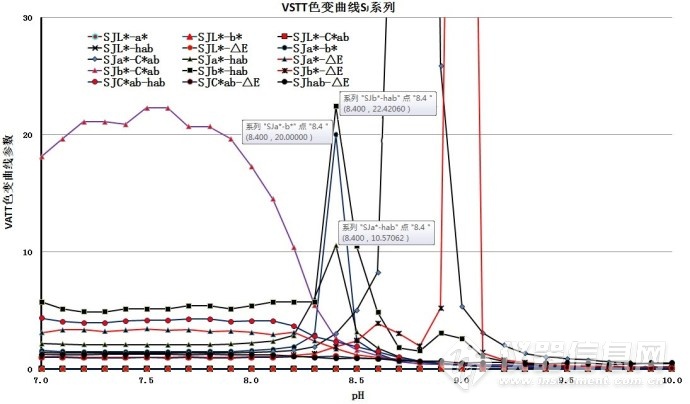
图5-2. VSTT不同参数的滴定终点(滴定终点附近)
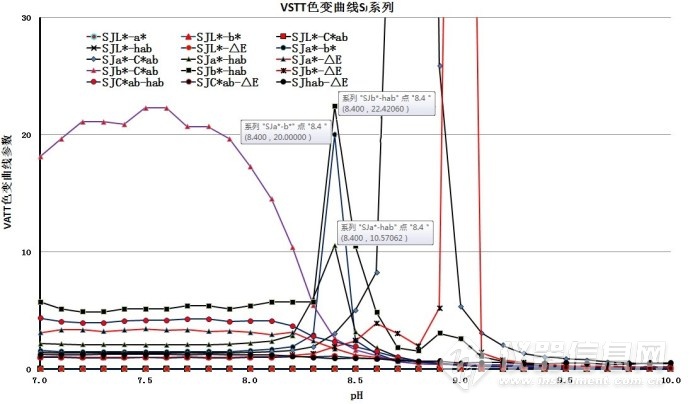
图5-3. VSTT不同参数的滴定终点(滴定终点附近,峰高最大20)
表3.滴定终点附近的色变曲线参数
| 序号 | VSTT色变曲线参数 | 色变曲线滴定终点的pH | 峰高 |
| 1 | SJa*-Cab* | 8.8 | 200 |
| 2 | SJb*-△E | 8.8 | 150 |
| 3 | SJb*-hab | 8.4 | 20 |
| 4 | SJa*-b* | 8.4 | 20 |
| 5 | SJa*-hab | 8.4 | 10 |
色变曲线参数SJb*-hab、SJa*-b*和SJa*-hab的滴定终点值均解决最初变色点,变色点的pH均为8.4。色变曲线参数SJb*-hab和SJa*-b*的峰高为SJa*-hab的2倍,优先选择SJb*-hab和SJb*-hab参数;曲线峰的峰底宽度和基线噪音方面分析,SJa*-b*明显优于SJb*-hab。
所以,优先选用色变曲线参数SJa*-b*为实验参数。
9.4.7、滴定精度
人工滴定时,由于滴定管的标准形状和材质,最小一滴的体积为50μL左右,由于只有1滴,无法进行精细的区分。VSTT方法中慢速滴定模式,最小进样量为0.426 Ml/步 ,将正常的“1滴”分为“100滴”(100步),而且同步记录每步的光谱参数值,从而通过将加入量最小化而建立更精准的滴定控制精度。非常适用于空白等微量体积加入建立VSTT色变曲线。
9.4.8、滴定试剂脉动加入与搅拌速度的影响
滴定分析中反应试剂的加入是不连续的脉动式加入,不可避免的在加入——停顿——加入过程中产生相对于整体反应体系的局部试剂浓度梯度。在搅拌混匀中伴随浓度梯度的不断改变,形成断续的团扇羽状的局部区域,该区域产生浓度过高(过滴定终点,局部颜色变色)——浓度稀释(未到滴定终点,局部颜色变浅)——浓度继续稀释(局部颜色变浅甚至消失)的现象,我们叫这种现象为试剂梯度扩散引起的色团羽流。根据经验,本次实验的搅拌速度在350 rpm~450 rpm为佳。
9.13、VSTT与人工感官滴定结果t检验与适用范围
用人工感官滴定与VSTT进行测量,选择接近变色点的VSTT不同VSTT色变曲线参数,比较二种方法在统计学上的差异。
对不同浓度的氢氧化钠标准溶液分别进行了人工感官方法(甲乙两组)与VSTT方法的比对实验,见表4。
表4. 不同浓度的氢氧化钠标准溶液的比较(20℃)
| 浓度 | 方法 | 组 | 邻苯二甲酸氢钾称样量g | 滴定体积mL | 标定浓度c(NaOH) mol/L | CrR95(4)(%) | CrR95(8)(%) | 标定浓度平均值c(NaOH) mol/L | RSD(8)(%) | t | 双尾P(sig.) | 上限 | 下限 |
| 1.0 | 感官滴定 | 甲 | 7.5009 7.5023 7.5027 7.5134 | 36.545 36.445 36.495 36.545 | 1.00642 1.00937 1.00804 1.00810 | 0.08 | 0.142 | 1.0055 | 0.167 | 1.653 | 0.121 | 0.00264 | -0.00034 |
| 乙 | 7.5126 7.5034 7.5031 7.5060 | 36.545 36.645 36.545 36.595 | 1.00799 1.00401 1.00672 1.00573 | 0.12 | |||||||||
| VSTT滴定 | 7.5312 7.5125 7.5430 7.5322 7.5158 7.5381 7.5346 7.5625 | 36.654 36.653 36.755 36.665 36.643 36.775 36.755 36.892 | 1.00748 1.00501 1.00628 1.00731 1.00573 1.00508 1.00516 1.00513 | ---- | 0.161 | 1.0059 | 0.101 | ||||||
| 0.5 | 感官滴定 | 甲 | 3.6231 3.6640 3.6200 3.5881 | 36.210 36.581 36.128 35.815 | 0.49062 0.49113 0.49132 0.49124 | 0.058 | 0.119 | 0.4913 | 0.103 | -1.420 | 0.177 | 0.00017 | -0.00084 |
| 乙 | 3.4820 3.6582 3.8251 3.6210 | 34.728 36.485 38.235 36.092 | 0.49167 0.49162 0.49050 0.49195 | 0.111 | |||||||||
| VSTT滴定 | 3.4882 3.5276 3.5551 3.4952 3.4905 3.5217 3.5011 3.4922 | 34.771 35.145 35.378 34.775 34.801 35.100 34.897 34.750 | 0.49123 0.49149 0.49206 0.49216 0.49113 0.49130 0.49127 0.49209 | ---- | 0.148 | 0.4916 | 0.089 | ||||||
| 0.1 | 感官滴定 | 甲 | 0.7482 0.7462 0.7467 0.7482 | 35.940 35.898 35.916 35.923 | 0.10194 0.10179 0.10180 0.10199 | 0.11 | 0.14 | 0.1019 | 0.105 | -2.987 | 0.010 | -0.00006 | -0.00035 |
| 乙 | 0.7522 0.7575 0.7582 0.7657 | 36.170 36.373 36.378 36.755 | 0.10183 0.10198 0.10206 0.10201 | 0.08 | |||||||||
| VSTT滴定 | 0.7371 0.7382 0.7336 0.7378 0.7385 0.7362 0.7369 0.7358 | 35.312 35.446 35.244 35.404 35.410 35.309 35.303 35.174 | 0.10221 0.10198 0.10192 0.10204 0.10212 0.10210 0.10221 0.10243 | ---- | 0.14 | 0.1021 | 0.156 | ||||||
注1:0.1 c(NaOH) mol/L时的空白体积,感官滴定为(一滴,约为50μL) 0.05 mL,VSTT滴定为 0.043 mL ;0.5 c(NaOH)mol/L和1 c(NaOH) mol/L的空白体积,为 0.05 mL。
注2:感官滴定按照规定每人四平行测定结果极差的相对值不得大于重复性临界极差[CrR95(4)]的相对值0.15%,两人共八平行测定结果极差的相对值不得大于重复性临界极差[CrR95]的相对值0.18%。VSTT无法分组,按照八平行测定结果极差的相对值不得大于重复性临界极差[CrR95]的相对值0.18%。
注2:上限和下限均指95%差异数的置信区间。
注2:N=6;自由度df=5。
表4的t检验结果显示,VSTT法参数(SJb*-hab、SJa*-b*和SJa*-hab)与人工感官滴定结果在统计学上均无显著性差异(P>0.05)。后期实验选择该参数为实验用参数。
表5结果表明,VSTT方法与国标的人工感官滴定方法没有差异,人工感官滴定和VSTT法参数的精密度RSD%均在0.1%~0.2%。
10、结论:
VSTT方法进行氢氧化钠标准溶液浓度的标定,与国标的人工方法没有差异,其它方法学参数符合国家标准要求。
明显的优点是,遵循吸收光谱变化确定滴定终点的技术路线,建立的VSTT方法的SJa*-b*色变曲线,终点峰值明显,操作方法简单,与人工感官滴定相比有明显的优势,实现滴定自动化、测量结果数字化、滴定终点图形化,克服人工感官滴定方法的色评价条件影响、避免人色观察阈值不一致、语言描述理解困难和无法量值溯源的痼疾,可替代、克服中颜色终点判断缺陷,实现滴定分析颜色判定终点方法的数字化、曲线化、量值可溯源。12、参考文献:
[1] HG/T4100-2009化学试剂 酚酞..北京:中国标准出版社,2010;
[2] 杭州大学化学系分析化学教研室.分析化学手册(第二版)第二分册 化学分析.[M].北京:化学工业出版社,1997;
[3] 李少聪.化学指示剂与生物染色剂制备手册.[M].北京:中国石化出版社,2015.
[4] 化源网.https://www.chemsrc.com/cas/77-09-8_895872.html;
[5] 物竞数据库.http://www.basechem.org/chemical/837;
[6] 王万林,史建公,刘鑫.酚酞指示剂在酸溶液中的颜色变化及其变色机理.[J].化学世界,第3期,2010;
[7] 武汉大学.分析化学(第四版).[M].北京:高等教育出版社,2000;
[8] GB/T 603-2002 化学试剂 试验方法中所用制剂及制品的制备..北京:中国标准出版社,2003;
[9]GB/T 601-2002 化学试剂 标准滴定溶液的制备.[M].北京:中国标准出版社,2002.
[10] 王飞.化学光谱滴定技术.[M].北京:中国标准出版社,2019;
[11] HJ168—2020,环境监测分析方法标准制订技术导则.北京:中国标准出版社,2021.
[12]GB/T27404-008,实验室质量控制规范 食品理化检测.北京:中国标准出版社,2008.