

柏坡
第2楼2009/06/09
1、新药的有效期也是通过加速和长期稳定性试验来确定的,根据新药的种类、剂型、稳定性、来制定稳定性试验的方法。另有规定外,一般都是通用的可参考药典附录。
2、已有国标的药品、凡是规定有效期的药品,应严格按照规定的贮藏条件保管,必须在有效期内使用。 超过失效期或有效期的药品按劣药处理,不得使用。
3、这个是需要做加速试验的,也就是说不同的制药企业申报生产同一种药时都要分别做这方面的试验,拿出验证材料,用于审批。有效期的制定也是通过稳定性试验。
hrmashimin
第5楼2010/02/03
1、新药的有效期是根据长期稳定性试验结果来确定的
2、已有国家药品标准的品种有效期也要靠长期稳定性试验结果来确定、因为工艺、处方、包装等不一样会影响有效期的。
3、申报生产与申报临床的单位不同,一般需要重新做长期稳定性试验,因为单位不同会有很多地方变更的,一旦变更,基本上要重新做长期稳定性试验的,如变更较大,也需要做加速试验。
东风恶
第6楼2010/02/03
有效期系指市售包装药品在规定的贮存条件下放置,药品的质量仍符合注册质量标准的时间段。药品的有效期应综合加速试验和长期试验的结果,进行适当的统计分析得到,最终有效期的确定一般以长期试验的结果来确定[1]。
但在审评工作中,建立有效期时仍然遇到一些问题。如基于商业需要,生产企业通常希望将有效期订得时间更长,但却往往忽略一些可能影响药品质量和安全性的因素,如较少考虑所销售区域的高温、高湿、强光等特殊气候环境对药物稳定性影响等。本文就确定有效期时需要关注的几点总结如下,供参考。
一、建立有效期的稳定性试验基础应可靠
稳定性试验基础系指加速试验和长期试验的试验设计应合理,样品的批次和规模应符合要求,考察项目应全面且具有灵敏性,各项目的分析方法应经过充分验证,测试试验数据应准确等。没有以上这些试验基础,是无法准确确定有效期的,也就无法保证上市后产品在一定时期内的质量和安全。
例如,某补充申请延长有效期(由24个月至36个月),但所使用的样品批次仍为申请注册上市的中试规模产品,此情形下延长有效期至36个月则欠妥。通常,生产企业应在批准上市后使用大生产规模的批次继续进行长期试验,此时需提供大生产规模稳定性数据才有可能支持36个月有效期。
还有一种较常见的情况是,在建立或延长有效期时,长期试验缺少对有关物质或降解产物等关键指标的考察,此时无法全面评价药物质量随时间的变化,因此无法支持所申请的有效期。
二、应考虑产品销售区域的特定气候的影响
目前,稳定性长期试验所采用的一般条件是根据国际气候带制定的。Paul Schumacher在1972年,Wolfgang Grimm 在1986 和1998年根据国际四个不同气候带定义了四个稳定性长期试验条件,在这四种气候带中,对于药品的质量保证而言,条件最苛刻的是第四种气候带,即高温又高湿的环境。上述作法被一些国家当局所采用并逐渐成为稳定性研究的标准作法。在2005年10月日内瓦举行的WHO关于药物制备规范专家委员会第四次会议上,建议将气候带IV(湿热带)分为 IVA和IVB两个气候带,其中 IVA的长期稳定性条件为30°C/65% RH,IVB为30°C/75% RH。WHO草案推荐的气候带分区和相应的长期稳定性试验条件见下表[2]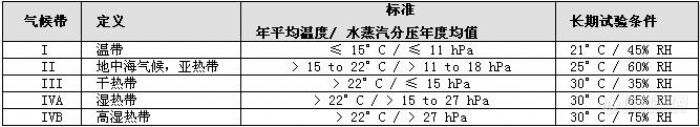
东风恶
第7楼2010/02/03
我国现有指导原则采用的是第二种气候带[1],考虑了我国各地平均的温度和湿度,国内申报资料中的长期试验条件通常为:25℃±2℃,60%RH±10%RH。 但这仅是一般要求,起草指导原则时并没有考虑一些特殊情况。
例如我国地域辽阔,东西经度和南北纬度跨度很大,各地间的气候有很大差异,如海南与我国东北(如黑龙江省)、西北(如新疆)等在温度、湿度、光照等方面的差别就比较显著,如果细分一下,我国局部区域可能会处于气候带III,甚至IV。同一药品在这几个地方的稳定性可能就会不同,在制定有效期时就需要考虑这些差别,有可能同样药品在这几个不同地区上市使用时具有不同的有效期。如果忽略这些差别,同时在长期试验设计时也没有考察某些高温、高湿、强光等苛刻气候条件的稳定性,则很可能药物在这些特殊气侯环境下储存和销售使用时,出现有效期内产品质量不合格的情况。
ICH Q1F针对气候带Ⅲ和IV的稳定性注册数据进行了单独规定[5],建议将30℃±2℃,65%RH±5%RH作为长期稳定性试验条件。而WHO之所以细分了气候带IV,也是考虑到了尽管同属湿热带,但其中湿度的不同也会对药物稳定性产生不同的影响。
由于生产企业对药物质量负有主要责任,因此建议企业需要根据自身药品销售使用区域的气候条件,在按照我国指导原则进行长期试验(25℃±2℃,60%RH±10%RH。)的基础上,再增加湿度及温度,采用气候带Ⅲ或气候带IV的长期试验条件考察一定时间,以获得这些特殊气候区域下的稳定性数据,确保药物在这些地域销售使用的稳定性。假如药物在炎热潮湿地区使用,则应有30℃/RH65%以上的长期稳定性试验数据支持,如果结果表明不稳定,则应采取相应的措施,如使用保护性更好的包装(例如固体制剂使用双层铝箔泡罩包装)来提高稳定性。
三、必要时进行特定的极端试验考察药物稳定性
我国指导原则中,指出对于易发生相分离、黏度减小、沉淀或聚集的药品需通过低温或冻融试验来验证其运输或使用过程中的稳定性,作为影响因素试验的一部分。并推荐了具体方法[1]。这项试验对于应用于低温或寒冷气候部分制剂非常必要,如难溶性主药制成的注射液、软膏剂、乳剂、栓剂、脂质体等,上述药物在这些地区销售或使用时,应进行低温冻融试验,以确保产品有效期内稳定。
在ICH Q1F中,对于在气候带III和IV上市的药物,对超过推荐的储藏条件以外的特殊运输和气候条件,应进行高温或极端湿度试验。如可对一批制剂在50℃下进行3个月试验以涵盖最热和最干的情况,在25℃,80%RH下进行3个月试验,以涵盖极端高湿的情况[5]。
可见,需要根据药物在特殊条件下的特殊情况,设计某些特定的极端条件组合试验,来考察特殊条件下的稳定性,确保极端情况发生时药物仍然稳定。
四、采用科学的统计分析方法建立有效期
由于长期稳定性试验采用多批样品,需要考察多个项目,每一个考察项目都会有多个试验数据,一般地,制定有效期时需要对这些大量的试验数据进行统计分析处理。基于此,国内外指导原则均建议采用统计分析的方法得到有效期。
我国指导原则也规定:由于试验数据的分散性,一般应按95%可信限进行统计分析,得出合理的有效期。如三批统计分析结果差别较小,则取其平均值为有效期,如差别较大则取其最短的为有效期。若数据表明测定结果变化很小,提示药品是很稳定的,则可以不做统计分析[1]。但该指导原则没有给出具体的统计分析方法,也缺少深入的分析,因此缺少可操作性。国内药企在确定有效期时,较少采用统计分析的方法确定有效期,多根据试验数据直观得到有效期,评判的主要依据是长期试验各考察项目在一定时间符合要求。由于缺乏对数据的科学统计分析,同时忽略了药物初始含量或杂质水平的变异程度对有效期可靠程度的影响,导致最终所建立的有效期缺乏高可信度。
ICH Q1A(R2)和WHO对此规定得略为具体[2-3]。在ICH Q1E中,对稳定性数据的评价方法和有效期(货架期)的确定进行了更为系统和详细的阐述,针对不同的贮藏条件、长期试验和加速试验是否明显变化、数据是否具有随时间变化的特性、数据能否进行统计分析等不同层面进行了详细讨论[4]。
国内在建立有效期时对试验数据的分析过于简单和粗略,应借鉴国外指导原则基础上,尽可能采取科学统计分析的方法得到可信度高的有效期。
五、必要时缩短有效期,预留足够的有效期内合格边界
通过以上分析,可以看出,我国研发企业在建立有效期时与国外指导原则还有很大的差距,同时,为了增加产品在有效期内符合要求的保证系数,在确定有效期时预留出足够的时间边界也是一个考虑的方法,这在ICH Q1F 2.3中得到了明确[5],它指出:如果不能证明放置在30℃±2℃,65%RH±5%RH条件下的药物或制剂,在其设置的有效期或再试验期内符合规定,应考虑缩短有效期或再试验期。
我们也可以借鉴这一作法,例如:如果长期试验进行了30个月,各项指标仍符合规定,但考虑到未评估药物初始含量或杂质水平的批间变异程度对有效期的影响,因此可适度缩减有效期至24个月,这样做的目的是确保药物在有效期内的质量,这对于某些稳定性差的药物或剂型(如注射液等)显得更有意义。
总之,在确定药物有效期时必须考虑到上述多种因素,根据需要增加高温高湿等特殊气候区域的稳定性试验、以及一些特定的极端试验考察药物稳定性,同时更多地采取统计分析的方法,必要时也应采取缩短有效期的方法充分保证药物质量合格边界,只有这样,才能建立合理的有效期,保证药物在有效期内的质量符合规定。上述稳定性试验相应的信息和所获得的结论应及时注明于药物说明书和标签中,以指导公众安全用药。
参考文献:
[1] 国家药品食品监督管理局.化学药物稳定性研究技术指导原则(2005年).
[2] 世界卫生组织.Guidelines for Stability of Pharmaceutical Products Containing Well Established Drug Substances in Conventional Dosage Forms: Stability Testing of Active Pharmaceutical Ingredients and Pharmaceutical Products(Draft)(2007年).
[3]ICH Q1A(R2):Stability Testing of New Drug Substances and Products(2003年).
[4]ICH Q1E:Evaluation for Stability Data. (2003年).
[5]ICH Q1F:Stability Data Package for Registration Applications in Climatic Zones Ⅲ and Ⅳ. (2003年).