

工农兵
第1楼2009/11/22
例.把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+ B.Al(OH)3
C.AlO2- D.Al3+和Al(OH)3
解析:使SO42-全部转化成BaSO4沉淀,1mol的KAL(SO4)2需2mol的Ba(OH)2,即1molAl3+对应4molOH-,此时铝元素的存在形式为AlO2-。故答案为C项。
答案:C
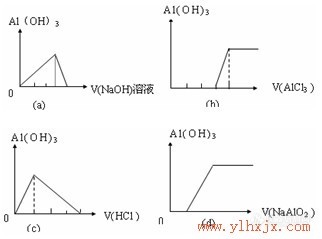
二、Al、Al2O3、Al(OH)3与酸、碱的反应
两性指某些既能与酸反应,又能与碱反应生成盐和水的物质具有的性质。如Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等物质都具有两性,称为两性物质。
弱酸强碱盐(如NaHCO3、NaHS、NaHSO3、Na2HPO4等)及弱酸弱碱盐(如CH3COONH4、NH4HS、NH4HCO3等),虽然既能与强酸反应又能与强碱反应,但不属于两性物质,因为它们与酸或碱反应时的生成物不全是盐和水。
Al能与酸和强碱溶液作用,但不属于两性物质,也不能说它具有两性。因为Al与强碱溶液反应的本质是:2Al+6H2O==2Al(OH)3↓+
3H2↑,Al(OH)3+NaOH==NaAlO2+2H2O,两式相加为2Al+2H2O+2NaOH==2NaAlO2+3H2↑。
Al不能直接与NaOH作用。
该文章转自[榆林教学资源网]:http://www.ylhxjx.com/tbfd/hxfd/gkhx/200911/7710_2.shtml
工农兵
第2楼2009/11/22
三、可溶性铝盐与强碱溶液反应的有关计算
⑴ 求产物Al(OH)3的量
当n(AI3+):n(OH-)≥1:3时,n[Al(OH)3]=(1/3)n(OH-);
当1:4<n(AI3+):n(OH-)<1:3时, n[Al(OH)3]=4n(AI3+)-n(OH-);
当n(AI3+):n(OH-)≤1:4时,n[Al(OH)3]=0。
⑵ 求反应物碱的量
当n[Al(OH)3]=n(AI3+)时,n(OH-)=3n(AI3+);
当n[Al(OH)3]<n(AI3+)时,若碱不足,n(OH-)=3n[Al(OH)3],若碱过量,n(OH-)=4n(AI3+)-n[Al(OH)3];
例.现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90 mL 4mol·L-1的NaOH溶液,使其充分反应。设Al3+物质的量与总物质的量的比值为x。
⑴ 根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
⑵ 计算沉淀中只有Fe(OH)3的x取值范围。
请在下图中画出沉淀总量(mol)随x(0→1)变化的曲线。
⑶ 若Al3+和Fe3+的物质的量之和为Amol(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
解析:
⑴ x=0.4,则n(AI3+)=0.4×0.1mol=0.04mol,n(Fe3+) =0.1mol-0.04mol=0.06 mol。由反应
Fe3+ + 3OH- == Fe(OH)3↓
0.06mol 0.18mol 0.06mol
Al3+ + 4OH- == AlO2-+2H2O
0.04mol 0.16mol
余n(OH-)=0.09L×4mol·L-1-0.18mol-
0.16mol=0.02mol>0,所以有0.06molFe(OH)3沉淀。
⑵要使沉淀中无Al(OH)3,至少需n(OH-)=4×0.1xmol。
x为最大取值时,有0.1(1-x)×3mol+0.4xmol=0.09×4mol,x=0.6,所以在
0≤x≤0.6时,沉淀只有Fe(OH)3。
当x=0时,Fe(OH)3沉淀量为0.1mol;
当x=0.4时,Fe(OH)3沉淀量为0.06mol;
当x=0.6时,Fe(OH)3沉淀量为0.04mol。
在0.6≤x≤1内,总沉淀量n(总)=0.1mol
-(0.09×4-0.1×3)mol=0.04mol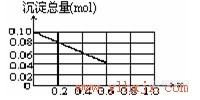
⑶ 3A(1-x)+4Ax=0.36,即x=(0.36/A)-3,(0.36/A)-3<x≤1,n[Fe(OH)3]=A(1-x)mol,
n[Al(OH)3]=4Ax-[0.36-3A(1-x)]=[A(x+3)-0.36]mol。