

lilongfei14
第1楼2011/11/19
二、酸碱滴定曲线和指示剂的选择
由于不同指示剂KHIn不同其变色范围也不同,要想正确反映理论终点的到达,必须了解滴定过程中pH值的变化规律,尤其是理论终点附近的pH值变化规律。
1、强碱滴定强酸(或强酸滴定强碱)
现以c(NaOH)=0.1000mol/L滴定20.00ml c(HCl)=0.1000mol/L溶液为例:
NaOH + HCl === NaCl + H2O
c(HCl)·V(HCl)= c(NaOH)·V(NaOH)
滴定过程分四个阶段:滴定前、理论终点前、理论终点、理论终点后。
(1)滴定前:c(HCl)= [H+] = 0.1000(mol/L)
pH=1.0
(2)滴定开始到理论终点前:加入18mLNaOH,余2.000mlHCl溶液。
0.1000 ×2.00
[H]= = 5.00 ×10-3(mol/L)
20.00 + 18.00
pH = -log5.0×10-3 = 2.30
加入19.80mLNaOH时,还余有0.20ml HCL溶液。
0.20 × 0.1000
[H+]= = 5.00 ×10-4(mol/L)
20.00 + 19.80
pH=3.30
(3)理论终点时:[H+] = [OH-] = 10-7 pH = 7
(4)理论终点后:当加入20.02mLNaOH溶液时,
0.1000 ×0.02
[OH-]= = 5.0 ×10-5(mol/L)
20.00 + 20.02
[H+]·[OH-] = 10-14
[H+] = 10-14 / 5.00×10-5 = 0.20×10-9
pH = 9.7
结果见表7-4(p245页)。
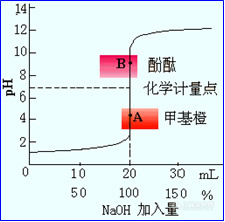
以溶液的pH值为纵坐标,以NaOH加入量为横坐标作图,即可得强碱滴定强酸的滴定曲线。如下图所示:
lilongfei14
第2楼2011/11/19
观察滴定曲线可看出:
①NaOH从0~19.98mL,pH从1.0增加到4.3,△pH=3.3,不显著渐变;
②在理论终点附近,NaOH从19.98~20.02mL,pH从4.3增加到9.7,△pH=5.4,变化近5.4个pH单位,即突跃范围。
③理论终点以后,pH主要由过量NaOH来决定。
lilongfei14
第3楼2011/11/19
突跃范围pH=3.3~10.7,甲基橙作指示剂。
例2:计算0.1mol/LNaOH滴定0.1mol/LHCl突跃范围。
突跃范围:pH= 4.3~9.7
例3:计算0.01mol/LNaOH滴定0.01mol/LHCl突跃范围。
加入19.98mLNaOH时,还余有0.02ml HCl溶液。
0.02 × 0.0100
[H+] = = 5.00 ×10-6(mol/L)
20.00 + 19.98
pH=5.30
当加入20.02mLNaOH溶液时,
0.0100 ×0.02
[OH-]= = 5.0×10-6(mol/L)
20.00 + 20.02
[H+]·[OH-] = 10-14
[H+] = 10-14 / 5.00×10-6 = 2.0×10-9 (mol/L)
pH=9.7
突跃范围:pH= 5.3~8.7,不能选用甲基橙作指示剂,可以选用酚酞、甲基红。
介绍图7-4(p245)。
[总结]:酸碱浓度对突跃范围有直接影响。每差10倍浓度,突跃范围差2个pH单位。
2、强碱滴定弱酸
有机原料乙酸总酸度的测定:
NaOH + HAc NaAc + H2O
水解,理论终点时溶液呈碱性。
NaAc + H2O HAc + NaOH
例:c NaOH = 0.1000mol/L (滴定管中)
c HAc = 0.1000mol/L (20ml进行滴定)
(1)滴定前:溶液的pH值
HAc H+ + Ac- Ka = 1.8×10-5
lilongfei14
第4楼2011/11/19
[H+] [Ac-]
KHAc = 平衡时 [H+] = [Ac-]
[HAc]
[H+] = { KHAc·[HAc] }1/2 = {1.8×10-5×0.1 }1/2 = 1.34×10-3(mol/L)
pH=2.9
(2)滴定开始到理论终点前:
复习缓冲溶液体系中HAc ~ NaAc
cHAc
pH = pKHAc - log
cNaAc
推导如下:HAc H+ + Ac-
[H+] [Ac-]
KHAc = 平衡时 [H+] = [Ac-]
[HAc]
[NaAc] ≈ [Ac-]
[HAc]
[H+] = KHAc·
[NaAc]
CHAc
pH = pKHAc - log
CNaAc
当加入19.98mL NaOH溶液时,剩余0.02ml HAc,
0.1000 × 0.02
[HAc] = = 5.0 × 10-5mol/L
20.00 + 19.98
0.1000 × 19.98
[Ac-] = = 5.0×10-2mol/L
20.00 + 19.98
5.0×10-5
pH = -log 1.8×10-5 -log = 7.7
5.0×10-2
(3)理论终点时
pH值按NaAc水解公式计算
Ac- + H2O HAc + OH-
lilongfei14
第5楼2011/11/19
[HAc] [OH-] [HAc] [OH-]
K水解= =
[Ac-]·[H2O] [Ac-]
KH2O = [H+]·[OH-]
[H+] [Ac-]
KHAc=
[HAc]
KH2O [HAc] [OH-] = = K水解
KHAc [Ac-]
理论终点时:[HAc] = [OH-] ,[Ac-] = cNaAc
[OH]2 KH2O =
cNaAc KHAc
[OH-]= {[KH2O/ KHAc]·cNaAc}1/2 ={[1×10-14/1.8×10-5 ]×(0.1000÷2)}1/2
=5.4 ×10-6(mol/L)
pH = 8.7
(4)理论终点后:NaOH抑制NaAc水解。
pH由NaOH的量计算,当NaOH的量20.02ml时:
0.1000 × 0.02
[OH-]= = 5.0×10-5 pH=9.7
20.00 + 20.02
该法计算结果在表7-5(p250页)。
由滴定曲线可以看出(滴定曲线见p251图7-5):
①起始点pH≠1。
②突跃范围在pH=7.7~9.7,碱性范围。
③由于滴定一开始即有NaAc生成,它抑制HAc离解,使pH急剧增大。也即[H+]降低。继续滴定时HAc浓度减少,NaAc浓度相应增大,形成缓冲溶液,pH值增大速度减慢,滴定曲线又呈现平坦状。接近终点时
lilongfei14
第6楼2011/11/19
HAc量很少,缓冲作用消失,水解作用增强,pH值急剧增大,理论终点附近有较少的滴定突跃在碱性范围。
④理论终点后:NaOH抑制NaAc水解,pH值由NaOH来决定。
突跃范围的影响:
①溶液浓度(酸和碱)大,范围大。
②弱酸电离常数Ka的大小及影响结果:
Ka越大→ 突跃范围越大;
Ka越小→突跃范围越小。
判断公式:
若C酸·K酸 ≤ 10-8时,无法进行滴定,无明显突跃范围,指示剂无法确定滴定终点。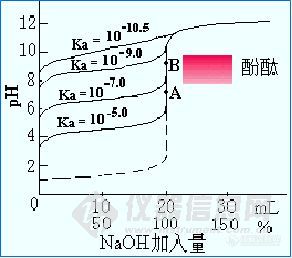
图2 NaOH溶液滴定不同弱酸溶液的滴定曲线
3、强酸滴定弱碱
以0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L氨水为例。
H+ + NH3·H2O H2O + NH4+
(1)滴定前 [OH-] =根号 KNH3·H2O ×[NH3·H2O]
(2)滴定开始到理论终点前
[NH3·H2O]
[OH-] = KNH3·H2O ×
[NH4+]
(3)理论终点时:
[H+] = { [KH2O / KNH3·H2O]×cNH4Cl}1/2
(4)理论终点后
[H+]= V酸过量 / V总量 ·C酸
讲解表7—6,绘成图 7—7,讲解的具体内容:
①与强碱溶液滴定弱酸的滴定曲线相似,只是pH变化相反。
②理论终点pH = 5.3,滴定突跃范围是6.3~4.3,因此只能选择酸性区域内变色指示剂,甲基红、溴酚蓝等。
③滴定突跃范围受碱的强度(Ka)和浓度(C碱)影响,由C碱·K碱 ≥10-8决定
lilongfei14
第7楼2011/11/19
4、多元酸的滴定
多元酸滴定的原则是什么?
①当C酸·K酸1 ≥10-8时,这一级离解[H+]可以被滴定。
②Ka1/Ka2 ≥104 则第一级离解[H+]被滴定,出现滴定突跃。较后离解即较弱的那一级离解的H+后被滴定,滴定的突跃取决于C·Ka ≥10-8。
③Ka1/Ka2 < 105,滴定时两个滴定突跃将混在一起,这时只有一个滴定突跃。
按照上述原则,以磷酸为例,说明该原则的应用:
H3PO3 H2PO4- + H+ Ka1 = 7.5 ×10-3
H2PO4- HPO42- + H+ Ka2 = 6.2 ×10-8
HPO42- PO43- + H+ Ka3= 4.8 ×10-13
当0.1000mol/L NaOH溶液滴定0.1000mol/L H3PO4溶液时:
(1)c·Ka1 = 0.1000 ×7.5 ×10-3 > 10-8
Ka1/Ka2 = 7.5 ×10-3/6.2 ×10-8 > 104
因此可以中和第一步离解的H+,得到第一步突跃。
(2)c·Ka2 ≈ 10-8
Ka2/Ka3 = 6.2 ×10-8/4.8 ×10-13 >105
因此可以中和第二步离解的H+,得到第二步突跃。
(3)c·Ka3 = 4.8 ×10-13·0.1000 < 10-8
滴定无明显突跃,不能继续滴定。
介绍p257页的滴定曲线,选指示剂。
介绍草酸和邻苯二甲酸的情况。
5、盐类滴定:(介绍Na2CO3)
Na2CO3强碱弱酸盐,其水溶液显碱性,可以用强酸滴定。
CO32- + H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
第一理论终点pH = 8.3(计算)
由于NaHCO3具有一定缓冲作用,所以滴定突跃不明显。
第二理论终点pH = 3.9,可选甲基橙为指示剂。
介绍P259页图7-9滴定曲线及Na2CO3滴定特点。
注意:由于在滴定过程中形成CO2的饱和溶液,而使滴定终点提前出现,通
lilongfei14
第8楼2011/11/19
常在滴定至近终点时,加热煮沸除去CO2冷却后再滴定到终点。
第一理论终点VHCl1 = 第二理论终点V HCl2
Na2CO3 + HCl == NaCl + H2O + CO2
n(1/2 Na2CO3) =n(HCl)
m(Na2CO3) /M(1/2 Na2CO3) ×1000 = C(HCl)·V(HCl)
C(HCl)= m(Na2CO3) / V(HCl)·M(1/2 Na2CO3) ×1000
三、酸碱滴定法应用实例
1、胶粘剂碱度的测定
2、混合碱的测定
3、油脂中酸价的测定
讲课后评:酸碱滴定法是化学分析法的基础,要把理论讲透,这对今后其它滴定法的学习是有好处的。