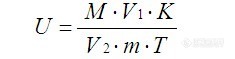酶活力的测定方法
(1)葡萄糖标准曲线的绘制
取8只洗净烘干的20 mL具塞刻度试管,编号后分别吸取0.0 mL ~ 1.4 mL葡萄糖标液用蒸馏水定容至2 mL,配置成一系列不同浓度的葡萄糖溶液。充分摇匀后,向各试管中加入1.5 mLDNS溶液,摇匀后沸水浴5 min,取出冷却后用蒸馏水定容至20 mL,充分混匀。在540 nm波长下,以1号试管溶液作为空白对照,调零点,测定其它各管溶液的吸光度值并记录结果。以葡萄糖含量为横坐标,以对应的吸光度值为纵坐标,绘制出葡萄糖标准曲线。
(2)滤纸酶活力的测定
取4支洗净烘干的20 mL具塞刻度试管,编号后各加入0.5 mL酶液和1.5 mL 0.05 mol/L pH 4.5的柠檬酸缓冲液,向1号试管中加入1.5 mL DNS溶液以钝化酶活性,作为空白对照,比色时调零用。将4支试管同时在50℃水浴中预热5 min ~ 10 min,再各加入滤纸条50 mg(定量滤纸,约1 cm × 6 cm),50℃水浴中保温1 h后取出立即向2、3、4号试管中各加入1.5 mL DNS溶液以终止酶反应,充分摇匀后沸水浴5 min,取出冷却后用蒸馏水定容至20 mL,充分混匀。以1号试管溶液为空白对照调零点,在540 nm波长下测定2、3、4号试管液的吸光度值并记录结果。
根据3个重复吸光度的平均值,在标准曲线上查出对应的葡萄糖含量,按下式计算出滤纸酶活力(U/g)。在上述条件下,每小时由底物生成1 μmol葡萄糖所需的酶量定义为一个酶活力单位(U)。
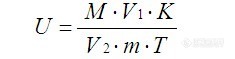
式中:U—滤纸酶活力(U/g); M—葡萄糖含量(mg);
V1—酶液定容总体积(mL); K—5.56为1 mg葡萄糖的μmol数;
V2—反应液中酶液加入量(mL); m—样品重(g);
T—时间(h)。
酶活力的测定结果
(1)葡萄糖标准曲线的绘制
采用分光光度计法,以葡萄糖在其最大吸收波长540 nm处绘制标准曲线,如图所示。

求得葡萄糖的回归方程为:
Y=0.7895X-0.0084 R2=0.9994
葡萄糖含量在0.00 mg ~ 1.40 mg范围内呈线性关系。
(2)酶活力的测定(滤纸法)
根据上式计算,滤纸法酶活力为5000 U/g,与酶制剂公司所提供酶活相一致。