利用硅胶膜法提取纯化质粒DNA
摘要:系统的阐述了质粒核酸提取过程中针对裂解和核酸纯化两大关键步骤的研究,重点介绍了利用硅胶膜法提取纯化核酸,以及在实验过程中的一些经验。
关键词:硅胶膜法;纯化;质粒DNA
一、前言
随着分子生物学技术的发展,核酸的分子生物学技术成为了药物研发、遗传病和感染性疾病的诊断、基因研究及物种鉴定等的常用研究手段之一。然而,核酸提取质量是进行下游一系列研究的关键,因此提取的方法会直接影响后续实验。
细菌质粒是一类双链闭合环状的DNA,大小范围从1kb至200kb以上不等。各种质粒都是存在于细胞质中、独立于细胞染色体之外的自主复制的遗传成份。质粒已成为目前最常用的基因克隆的载体分子,重要的条件是可获得大量纯化的质粒DNA分子。
硅胶膜法是一种应用最为广泛的提取纯化质粒DNA的方法,因硅基质材料可特异吸附核酸DNA,使用方便、快捷,不需要使用有毒溶剂如酚、氯仿等,使得提取质粒核酸像过滤一样简单。
二、实验部分
2.1 原理
硅基质材料吸附核酸的原理主要利用DNA在高盐低pH值环境下与硅基质材料相结合,在低盐高pH值环境下与硅基质材料脱离的特征。其机理是带负电荷的DNA和带正电的二氧化硅粒子之间有很强的亲和力。在高浓度盐离子的作用下,盐离子打破水中的氢和二氧化硅上带负电荷的氧离子间的氢键,DNA与硅基质紧密结合,洗涤除去其他杂质;再用低离子强度的TE缓冲液或蒸馏水洗脱结合的DNA分子,机理是当盐被清除后,再水化的硅基质破坏了基质和DNA之间的吸引力,因而DNA从硅基质上被洗脱下来。
2.2 主要试剂
溶液Ⅰ:50mM葡萄糖,25mM Tris-HCl(pH 8.0),10mM EDTA(pH 8.0)。
溶液Ⅱ:0.2NNaOH,1% SDS。
溶液Ⅲ:醋酸钾(KAc)缓冲液,pH 4.8。
漂洗液:60mM 乙酸钾、10mM Tris-HCl (pH 7.5) 、60% 乙醇
TE:10mMTris-HCl(pH 8.0),1mM EDTA(pH 8.0)。
2.3 主要步骤
该步骤采用CommaPrePTM的质粒小提纯化柱。

CommaPrep™核酸小提柱可用在核酸提取过程中过柱结合、洗涤、洗脱步骤中

1. 取1.5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000 rpm 离心1 min, 尽量吸除上清。
(注意:应根据所培养菌体的浓度与质粒的拷贝数,确定收集的菌液量。菌量过大可能导致溶菌不充分,纯化时会影响质粒纯度菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
2. 将细菌沉淀重悬于100uL溶液Ⅰ中,移液器或涡旋振荡器彻底悬浮细菌沉淀,使菌体分 散混匀。
(注意:如果有未彻底混匀的菌块,会影响裂解,导致提取量和纯度偏低。并且溶液Ⅰ中 要加入适量的RNA酶)
3. 向离心管中加入200uL溶液Ⅱ,温和地上下翻转数次,并将离心管放置于冰上2-3min,使细胞膜裂解。(注意:温和地混合,不要剧烈震荡,以免污染基因组DNA。此时菌液应变得清亮,如果未变得清亮,可能由于菌体过多,裂解不彻底,应减少菌体量。)
(注意:加入溶液Ⅲ后,要立即将管温和颠倒,避免产生局部沉淀。如果上清液中存在沉淀,可再一次离心。溶液Ⅲ为中和溶液,此时质粒DNA复性,染色体和蛋白质不可逆变性,形成不可溶复合物。)
5. 吸取上清至吸附柱(内管)中(吸附柱在离心管中),尽量不要吸出沉淀,12000rpm,离心30秒。弃去废液,将吸附柱重新放入一个新的离心管中。
6. 加入750uL的漂洗液(漂洗液要在实验前加入无水乙醇)12000rpm离心,1min。取出 DNA结合柱,弃废液,重新插入DNA结合柱到离心管中。
7. 用500uL漂洗液重复冲洗过程。12000rpm离心,1min。(注意:重复一次可以增加质粒的回收效率。)
8. 转移DNA结合柱到1个新的1.5mL离心管中,加入60uL的无核酸酶的水到DNA结合柱中,洗脱质粒DNA,室温条件下,12000rpm离心,1min。
(注意:不要转入DNA结合柱中的漂洗液,如果混有,就需要12000rpm离心,1min。洗脱缓冲液体积不少于50uL,体积小会影响回收效率。
洗脱液的pH值对于洗脱效率有很大的影响,若用水洗脱应保证pH值在7.0-8.5范围内, pH小于7会降低洗脱效率。如果长期保存DNA,洗脱液建议使用TE。)
9. 加入100uL的无核酸酶水到结合柱中,洗脱质粒DNA,离心12000rpm,1min。(注意:重复一次,增加洗脱效率。)
10.洗脱DNA后,从1.5mL离心管中取出DNA结合柱并废弃。
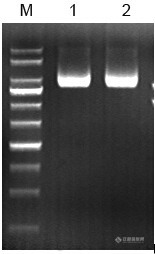
11.取2uLDNA进行电泳,检测DNA质量。
12.将纯化的DNA溶液于-20℃中。
三、实验结果
图为质粒DNA(10kb)的凝胶电泳图,说明提取效果较好。