

关键词:近红外光谱分析技术 人凝血因子Ⅷ 酸沉 效价 总蛋白
表1 标准蛋白溶液和待测样品的加样量和比例
| 孔数 | 蛋白浓度(μg/mL) | 标准或待测蛋白溶液体积(μL) | PBS缓冲液体积(μL) | WR体积(μL) |
| 1 | 0 | 0 | 20 | 200 |
| 2 | 25 | 1 | 19 | 200 |
| 3 | 50 | 2 | 18 | 200 |
| 4 | 100 | 4 | 16 | 200 |
| 5 | 200 | 8 | 12 | 200 |
| 6 | 300 | 12 | 8 | 200 |
| 7 | 400 | 16 | 4 | 200 |
| 8 | 500 | 20 | 0 | 200 |
| 9 | 待测样品 | 2 | 18 | 200 |
表2 样品的FⅧ效价(IU/mL)测定结果
| 编号 批次 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 1 | 9.33 | 8.59 | 8.72 | 8.43 | 8.19 | 7.76 | 7.43 | 7.58 | 6.49 | 6.31 | 3.97 | 5.93 | 3.80 | 2.18 |
| 2 |
| 10.85 | 10.32 | 7.96 | 7.74 | 7.17 | 9.50 | 6.04 | 6.00 | 5.78 | 4.97 | 6.86 | 4.38 | 3.61 |
| 3 | 4.21 | 4.08 | 3.14 | 3.32 | 2.83 | 2.62 | 2.56 | 2.00 | 1.94 | 1.43 |
|
|
|
|
| 4 | 5.35 | 5.50 | 4.66 | 4.69 | 5.18 | 4.71 | 4.49 | 3.97 | 3.70 | 3.40 |
|
|
|
|
| 5 | 10.28 | 10.81 | 10.12 | 9.11 | 8.02 | 6.61 | 7.97 | 7.89 | 8.81 | 7.80 |
|
|
|
|
| 6 | 11.24 | 12.28 | 13.26 | 9.89 | 8.57 | 7.46 | 7.97 | 6.64 | 5.50 | 3.97 |
|
|
|
|
| 7 | 9.68 | 8.86 | 9.95 | 10.63 | 9.57 | 8.33 | 8.11 | 7.30 | 6.72 | 5.41 |
|
|
|
|
| 8 | 10.81 | 10.69 | 8.96 | 8.91 | 7.71 | 6.79 | 6.50 | 6.11 | 6.08 | 4.98 |
|
|
|
|
| 9 | 11.11 | 10.40 | 10.46 | 9.57 | 10.28 | 8.20 | 7.80 | 8.02 | 7.10 | 5.50 |
|
|
|
|
| 10 | 10.03 | 11.09 | 9.60 | 10.03 | 8.47 | 8.15 | 8.63 | 8.43 | 7.54 | 5.54 |
|
|
|
|
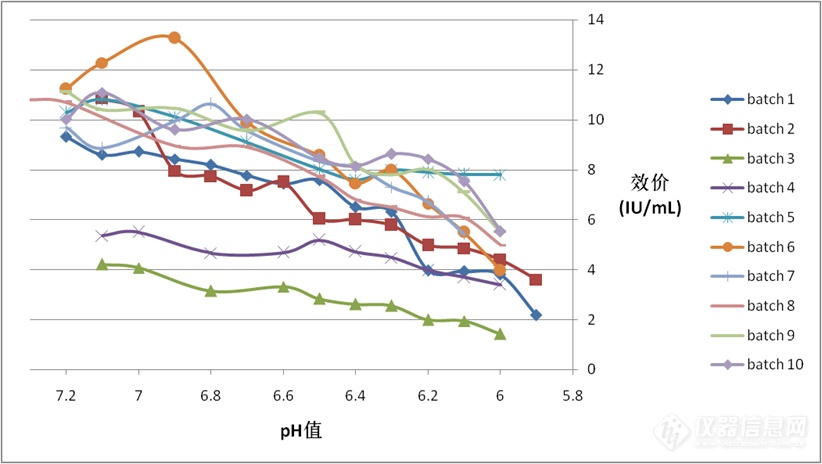
图1 样品的FⅧ效价变化趋势图
每次酸沉淀过程中溶解液FⅧ效价随pH值的变化情况如上图1所示。从图中可以看出,冷沉淀的溶解液初始pH值为7.2±0.1,随着滴加醋酸溶液,溶解液的pH值缓慢降低,一直到pH值为5.9±0.1时停止加酸,酸沉淀过程停止;由于留样批次和存放时间的不同,不同试验次数酸沉淀过程的溶解液初始FⅧ效价不尽相同,多数为10IU/mL左右,也有两次实验的溶解液初始FⅧ效价为4.2-5.3IU/mL,但是每次实验的溶解液FⅧ效价都随pH值的降低呈持续性下降的趋势,尽早结束加酸可以减少FⅧ活性的损失。
表3 样品总蛋白含量(mg/mL)测定结果
| 编号 批次 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 1 | 49.4 | 41.6 | 40 | 50.2 | 26.4 | 25.8 | 20.5 | 16.1 | 17.1 | 18.1 | 19.8 | 19.5 | 18.9 | 20.6 |
| 2 | 52.15 | 50.58 | 46.33 | 42.12 | 40.53 | 37.09 | 21.99 | 22.62 | 17.54 | 13.27 | 12.85 | 7.93 | 11.98 | 9.16 |
| 3 | 39.87 | 40.93 | 39.04 | 35.35 | 31.66 | 24.68 | 24.66 | 18.59 | 16.46 | 13.46 | 12.88 | 11.44 | 11.66 | 10.84 |
| 4 | 44.99 | 36.52 | 33.99 | 30.18 | 27.44 | 26.03 | 20.35 | 16.90 | 18.13 | 14.14 | 12.89 | 11.96 |
|
|
| 5 | 23.53 | 36.98 | 28.62 | 29.95 | 24.86 | 27.32 | 17.40 | 24.76 | 16.37 | 15.16 | 13.15 | 10.12 | 8.97 | 8.30 |
| 6 | 38.01 | 26.13 | 26.39 | 29.69 | 23.98 | 29.05 | 25.79 | 23.42 | 18.53 | 12.35 | 13.70 | 14.62 | 10.63 | 7.24 |
| 7 | 50.15 | 41.46 | 41.00 | 39.27 | 34.29 | 30.44 | 24.50 | 22.45 | 19.47 | 16.64 | 13.66 | 13.39 | 10.57 | 8.48 |
| 8 | 44.41 | 37.33 | 36.82 | 35.72 | 33.85 | 29.40 | 24.08 | 21.45 | 19.46 | 14.89 | 11.70 | 11.79 | 10.70 | 10.77 |
| 9 | 42.27 | 42.40 | 43.31 | 41.84 | 41.71 | 40.08 | 33.18 | 30.66 | 23.16 | 19.22 | 16.98 | 15.06 | 14.40 | 13.96 |
| 10 | 39.92 | 37.08 | 39.10 | 38.54 | 28.69 | 32.90 | 25.39 | 24.16 | 19.15 | 15.79 | 14.03 | 12.65 | 11.07 | 10.27 |
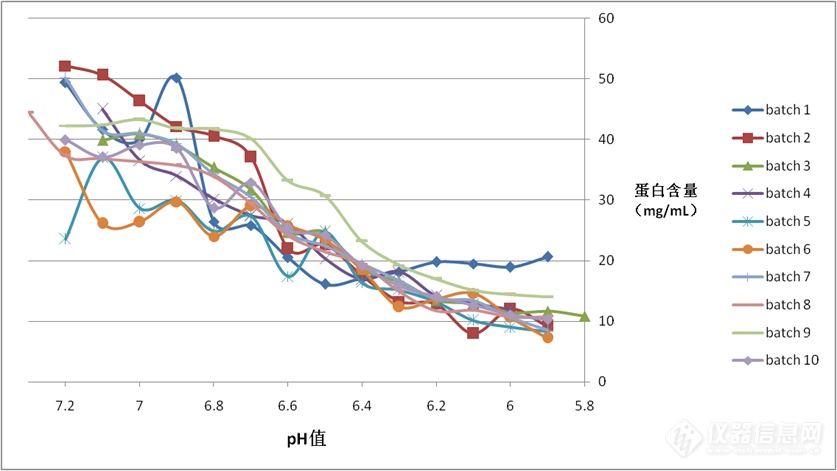
图2 样品总蛋白含量随pH变化趋势图
表4 样品的FⅧ比活性(IU/mg)结果
| 编号 批次 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 1 | 0.19 | 0.21 | 0.22 | 0.17 | 0.31 | 0.30 | 0.36 | 0.47 | 0.38 | 0.35 | 0.20 | 0.30 | 0.20 | 0.11 |
| 2 |
| 0.21 | 0.22 | 0.19 | 0.19 | 0.19 | 0.43 | 0.27 | 0.34 | 0.44 | 0.39 | 0.86 | 0.37 | 0.39 |
| 3 | 0.11 | 0.10 |
| 0.09 |
| 0.13 | 0.11 | 0.14 | 0.16 | 0.15 | 0.15 | 0.13 |
|
|
| 4 | 0.12 | 0.15 |
| 0.15 |
| 0.18 | 0.25 | 0.28 | 0.25 | 0.28 | 0.29 | 0.28 |
|
|
| 5 | 0.24 | 0.29 |
| 0.34 |
| 0.33 |
| 0.32 | 0.40 | 0.53 | 0.60 | 0.87 | 0.87 |
|
| 6 | 0.30 | 0.47 |
| 0.45 |
| 0.34 |
| 0.37 | 0.40 | 0.65 | 0.48 | 0.38 | 0.37 |
|
| 7 | 0.19 | 0.21 |
| 0.25 | 0.31 | 0.39 |
| 0.43 | 0.49 | 0.53 | 0.50 | 0.51 |
|
|
| 8 | 0.24 | 0.29 |
| 0.25 |
| 0.30 |
| 0.36 | 0.35 | 0.44 | 0.52 | 0.52 | 0.47 |
|
| 9 | 0.26 | 0.25 |
| 0.25 |
| 0.24 |
| 0.34 | 0.35 | 0.41 | 0.47 | 0.47 | 0.38 |
|
| 10 | 0.25 | 0.30 |
| 0.25 |
| 0.30 |
| 0.35 | 0.43 | 0.55 | 0.60 | 0.60 | 0.50 |
|
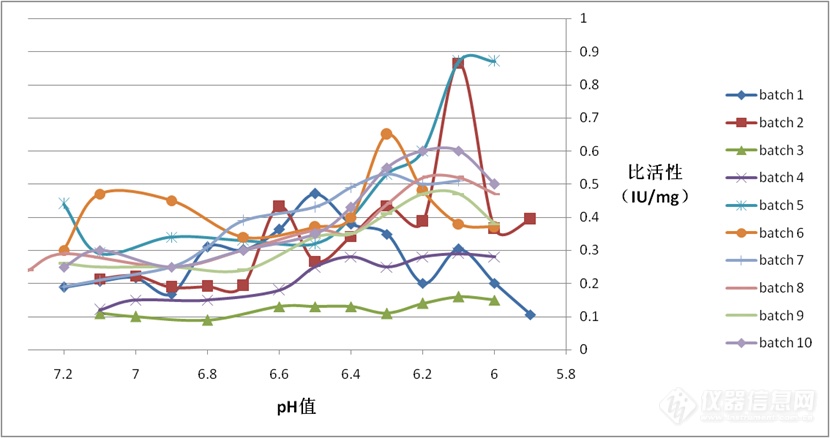
图3 样品FⅧ比活性随pH值变化趋势图
表5 FⅧ比活性最高时的溶液pH值情况
| 批次 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 初始比活(IU/mg) | 0.19 | 0.21 | 0.11 | 0.12 | 0.44 | 0.30 | 0.19 | 0.24 | 0.26 | 0.25 |
| 最高比活(IU/mg) | 0.47 | 0.86 | 0.16 | 0.29 | 0.87 | 0.65 | 0.53 | 0.52 | 0.47 | 0.60 |
| pH值 | 6.5 | 6.1 | 6.3 | 6.4 | 6.1 | 6.3 | 6.3 | 6.2 | 6.2 | 6.2 |
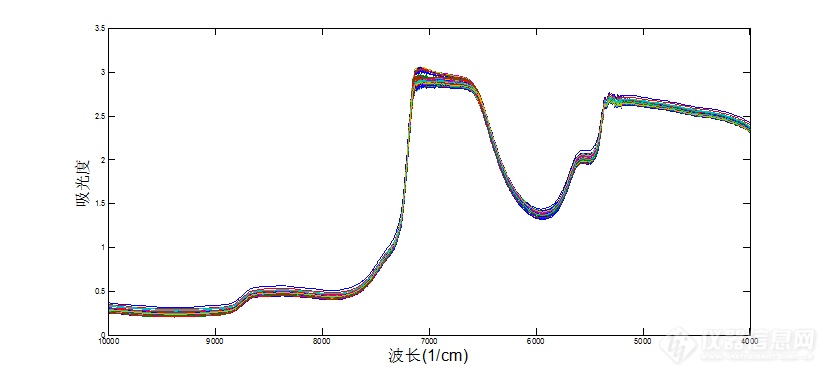
图4 酸沉淀过程中样品的近红外光谱图
表6 样品集信息表
| 样品集 | 数量 | 最大值(IU/mg) | 最小值(IU/mg) | 平均值(IU/mg) | 标准偏差 |
| 校正集 | 64 | 0.87 | 0.09 | 0.36 | 0.18 |
| 验证集 | 44 | 0.74 | 0.11 | 0.33 | 0.14 |
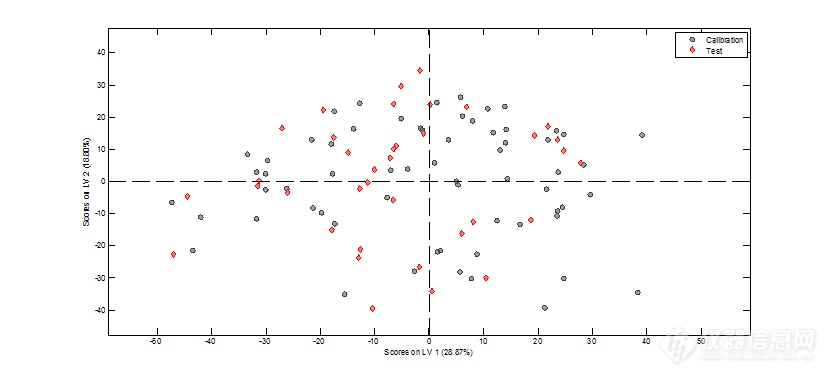
图5 样品的主成分得分图
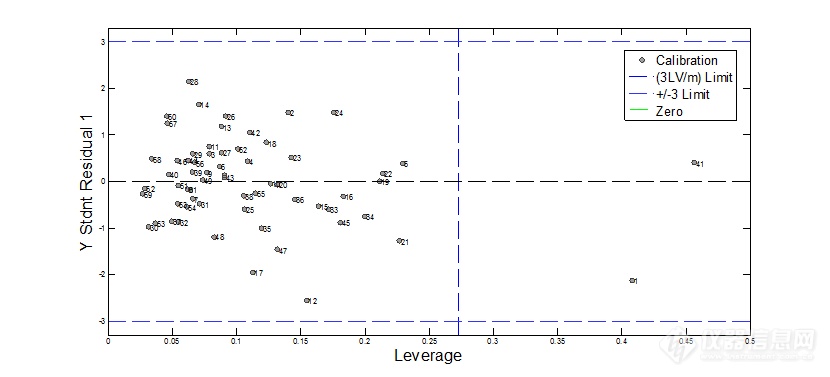
图6 学生化残差——杠杆值图
表7 不同窗口宽度平滑处理建模结果
| 预处理方法 | Rc | RMSEC |
| 一阶+SG11点 | 0.7915 | 0.1093 |
| 一阶+SG13点 | 0.9468 | 0.0576 |
| 一阶+SG15点 | 0.9289 | 0.0622 |
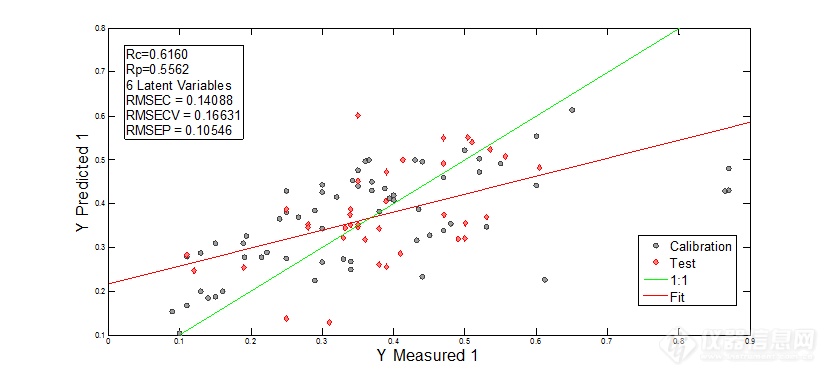
图7 未经预处理的光谱建模结果
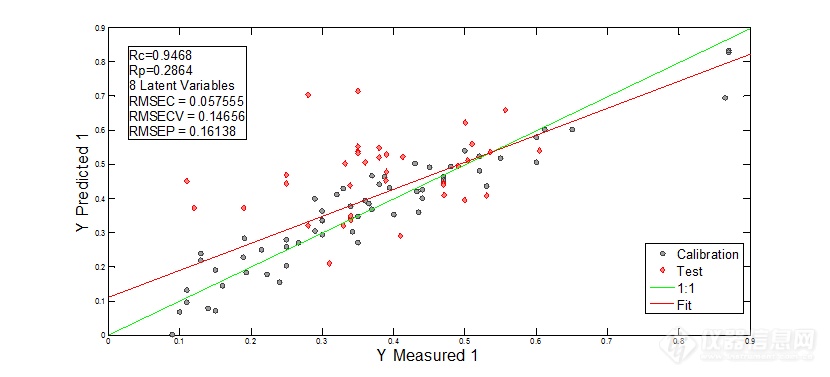
图8 一阶微分+SG13点平滑后光谱建模结果
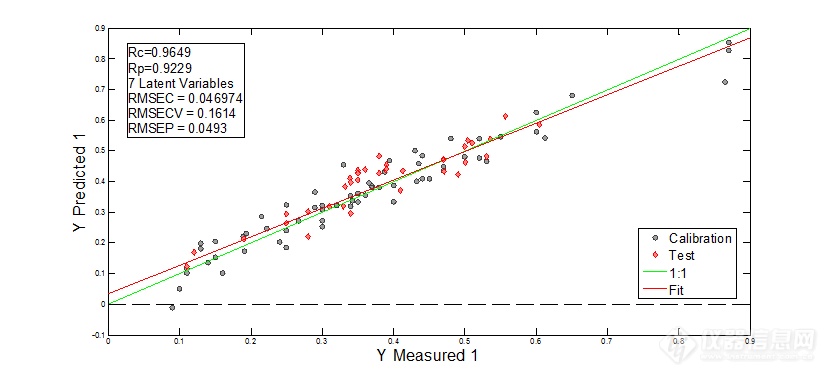
图9 一阶微分+SG13点平滑+Autoscale处理后光谱建模结果
表8 模型预测精密度结果
| 测量次数 | 比活性预测值(IU/mg) | ||
| 1-1号 | 4-7号 | 7-8号 | |
| 1 | 0.21 | 0.28 | 0.49 |
| 2 | 0.23 | 0.26 | 0.51 |
| 3 | 0.22 | 0.27 | 0.48 |
| 4 | 0.23 | 0.30 | 0.49 |
| 5 | 0.20 | 0.28 | 0.47 |
| 6 | 0.21 | 0.29 | 0.50 |
| 平均值 | 0.22 | 0.28 | 0.49 |
| 标准偏差 | 0.012 | 0.014 | 0.014 |
| 相对标准偏差 | 5.6% | 5.1% | 2.9% |