

原子荧光法测汞的试剂影响分析
The Effect of the Reagent on the Mercury by Aomic Fluorescence Spectrometry
Abstract:The concentrations of potassium borohydride and hydrochloric acid have important impact on the determination of mercury by atomic fluorescence spectrometry. In terms of perspective of chemical reaction and mathematical statistics,the impact was analyzed with qualitative and quantitative analysis method. The results show that when the concentration of potassium borohydride is 0.5 g/L,the average value of the curve slopes is 1262,and the standard deviation and dispersion coefficient is 8.4 % and 0.007,respectively. The measurement sensitivity and reliability are higher. When the concentration of hydrochloric acid is 5 %,the blank value is the lowest. Under the optimized experimental condition,0.25 μg/L and 0.50 μg/L standard samples were measured with a standard deviation of 1.1 % and 0.7 %,respectively,and the precision and accuracy are higher.
Key words:atomic fluorescence spectrometry;mercury;potassium borohydride;hydrochloric acid
汞及其化合物属于毒性物质,过量的汞被人体摄入后,会损害肾脏、心脏、甲状腺等器官,甚至造成神经系统紊乱和慢性汞中毒。同时,汞污染具有远距离迁移性、持久性及高生物富集性等特性,通过排放废水、废气、废渣等方式进入自然环境,对水体、空气、土壤、动植物等造成危害。因此,汞被联合国环境规划署列为全球性优先控制污染物,成为全世界广泛关注的环境污染物之一。在我国,水体汞污染主要是由工业废水排放引起的,有研究指出,吉林松花江流域、贵州万山地区等都曾受过严重汞污染,已出现人群汞中毒病例报告[3]。鉴于此,《污水综合排放标准(GB 8978-1996)》规定汞排放浓度不得超过0.05 mg/L。此外,新型人工合成化学物质的投入使用,导致地下水中含汞化学组分发生了变化。2017年新颁布的《地下水质量标准(GB/T 14848-2017)》对汞的指标限值进行了相应的修订,例如,Ⅰ类水标准由0.05 μg/L修订为0.1 μg/L,Ⅱ类水标准由0.5 μg/L修订为0.1 μg/L。因此,不断提高测量技术,准确测定水中汞含量,对人体健康和环境安全具有重要的意义。
目前,我国研究人员对汞的测量方法进行了大量的研究,包括分光光度法、冷原子吸收光谱法、冷原子荧光法、阳极溶出伏安法、电感耦合等离子体质谱法以及生化检测方法等。其中,原子荧光法具有检出限和测定下限低、灵敏度高、干扰因素少、操作简便等优点,是国内环境监测领域普遍采用的测汞方法。然而不同实验室的环境参数、仪器类型、测量条件等存在差异,因此需要不断优化测量条件,提高分析灵敏度和精密度。在测量过程中会受到一些因素的影响,其中,硼氢化钾和盐酸浓度的影响较为关键。本研究通过量化分析试剂的影响,确定最佳浓度,以满足测量天然水体中痕量汞的测定要求。
1. 实验方法
1.1 原理
在酸性介质中,二价汞离子被硼氢化钾还原成汞原子,由载气(氩气)带入原子化器,氢气与氩气在点火装置作用下形成氩氢火焰。在汞空心阴极灯照射下,基态汞原子受激发并跃迁至高能态,然后由去激发由高能态跃迁至基态时,产生具有特征波长(253.7 nm)的原子荧光。根据朗伯-比尔定律,在一定范围内汞浓度与荧光强度成正比,由此可测量汞浓度。
1.2 仪器与试剂
1.2.1 仪器参数
表1 仪器参数设置
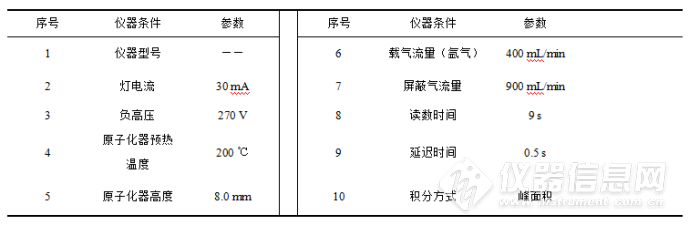
(注:为避免广告嫌疑,仪器型号已略去)
1.2.2 试剂
1) 实验用水:电导率为18 mΩ·cm的去离子水;
2) 盐酸、硝酸、硼氢化钾、氢氧化钾均为优级纯;
3) 汞标准溶液:100 mg/L,由环境保护部标准样品研究所提供;
4) 汞固定液:0.5 g重铬酸钾溶于950 mL水,加入50 mL硝酸,充分混匀;
5) 汞标准储备液:量取10.0 mL汞标准溶液至500 mL容量瓶中,用汞固定液稀释至标线,充分混匀,该溶液的汞浓度为2.0 mg/L;
6) 汞标准中间液:量取2.5 mL汞标准储备液至250 mL容量瓶中,用汞固定液稀释至标线,充分混匀,该溶液的汞浓度为20.0 μg/L;
7) 汞标准使用液:量取5.0 mL汞标准中间液至100 mL容量瓶中,加入体积分数5%盐酸定容至标线,充分混匀,该溶液的汞浓度为1.0 μg/L;
8) 本实验所用仪器可自动配制标准溶液系列,汞浓度分别为0.1 μg/L、0.2 μg/L、0.4 μg/L、0.8 μg/L、1.0 μg/L;
9) 汞标准质量控制样品(编号202036):量取10.0 mL该溶液至250 mL容量瓶中,加入3 %硝酸定容至标线,充分混匀,该样品浓度范围为6.68±0.73 μg/L,由XX样品研究所提供。(注:标准样品名称已略去)
1.2.3实验步骤
按照表1内容设置仪器参数,根据仪器操作规程进行测量。
2. 结果与讨论
2.1 硼氢化钾浓度对荧光强度的影响
在酸性条件下,样品溶液中的汞(Hg)与硼氢化钾(KBH4)反应生成汞蒸气。化学反应方程式如下:
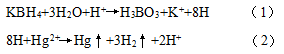
硼氢化钾的分解在pH 3.8-14之间为二级反应,反应速率常数为1.22 × 108 mol/min(30 ℃),该反应可在极短时间内完成,表明硼氢化钾的稳定性较差。在酸性条件下,硼氢化钾易分解产生氢气,所以需要先配制碱液再加入硼氢化钾,以抑制反应向右进行,防止溶液中硼氢化钾分解损失。在碱性条件下,硼氢化钾可将离子态汞还原成原子态汞。由朗伯-比尔定律可知,汞浓度与荧光强度成正比,当汞浓度变化时,荧光强度也随之变化,因此硼氢化钾浓度也会对荧光强度产生影响。硼氢化钾浓度过低,汞难以被充分还原,导致荧光强度偏低;浓度过高,产生大量的氢气会稀释汞浓度,同样导致荧光强度降低。硼氢化钾浓度的确定,应满足两个要求,一是硼氢化钾浓度应是稍过量的,使样品溶液中的汞被充分还原;二是硼氢化钾溶液为临用现配,在测量结束后往往会有剩余,在充分还原汞的前提下,应减少试剂消耗量,降低对环境的污染。不同研究者对硼氢化钾最佳浓度进行了研究,研究结果见表2。
表2 不同试剂浓度及仪器参数比较
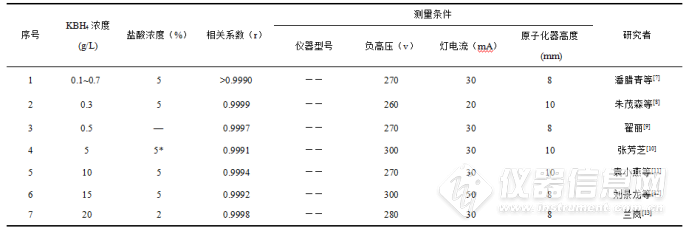
注:“—”表示作者未该数据;“*”表示硝酸浓度。(仪器型号已略去)
表3 硼氢化钾浓度测量结果
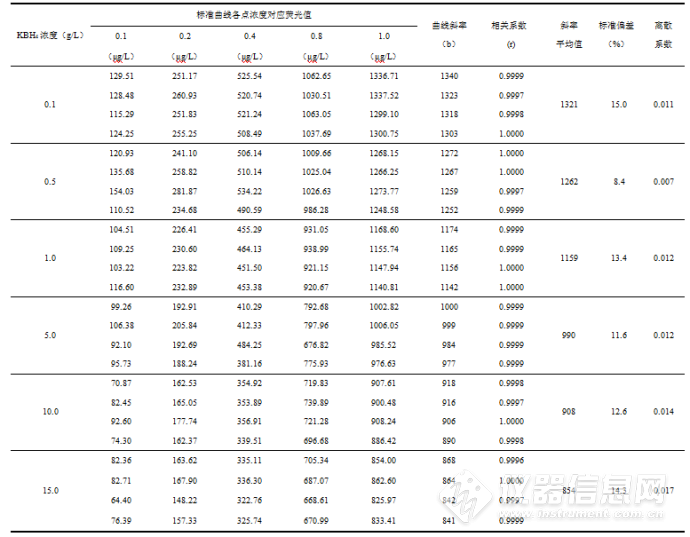
由表3可知,硼氢化钾浓度从0.1 g/L到15.0 g/L变化时,斜率变化范围为841~1340,相关系数变化范围为0.9996~1.0000,说明各浓度硼氢化钾线性拟合度较好。在统计学中,用斜率表征测量方法的灵敏度,灵敏度越高,单位浓度待测物质变化引起的测量信号响应量越大,反之越小。对硼氢化钾各浓度对应的曲线斜率求平均值,计算结果见表3。当硼氢化钾浓度为0.1 g/L时,灵敏度最高,其值为1321;浓度为15.0 g/L时,灵敏度最低,其值为854。可见,随着硼氢化钾浓度升高,平均斜率呈下降趋势。根据式(1)和式(2)反应原理,硼氢化钾浓度升高时,稀释了原子态汞的浓度,从而降低了汞的荧光强度,灵敏度降低。朱茂森等[8]研究结果表明,当硼氢化钾浓度从0.3 g/L升高到20.0 g/L时,曲线的斜率逐渐降低,与本研究结果一致。从灵敏度角度分析,测量溶液中的汞应尽量使用低浓度硼氢化钾,以提高测量精确度。
然而,灵敏度越高不代表测量效果越好。当灵敏度高时,若曲线波动较大,会导致误差增大,稳定性和可靠性降低。引用数理统计中标准偏差和离散系数进行分析,可量化评价测量结果的稳定性和可靠性。标准偏差用来表征该组数据的离散性,计算方法见式(3);当不同组数据的平均水平相差较大时,可用离散系数来评价其离散性,计算方法见式(4)。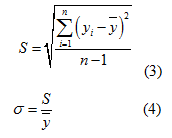
 为斜率平均值,n为测量次数,σ为离散系数。
为斜率平均值,n为测量次数,σ为离散系数。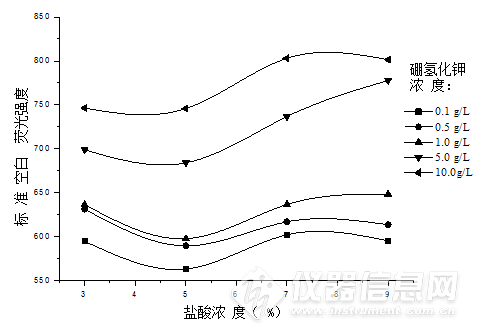
图1 盐酸浓度与硼氢化钾浓度对空白值的影响
由图1可知,当硼氢化钾浓度不变时,随着盐酸浓度升高,空白荧光值呈先下降后上升的趋势,盐酸浓度为5 %时空白荧光值最低。盐酸作为载流,有两方面作用,一是使硼氢化钾在酸性条件下维持稳定的分解速率,二是使汞元素保持一定的价态。在5 %盐酸浓度下,硼氢化钾可维持较高的分解速率,且汞在反应过程中保持稳定的价态,这些因素有利于降低空白荧光值,浓度过低或过高都会导致空白荧光值升高。因此,5 %盐酸浓度可作为载流的最佳浓度。此外,由图1可知,盐酸浓度一定时,随着硼氢化钾浓度升高,空白荧光值也随之升高。这也可以解释本文上节中硼氢化钾浓度升高则汞荧光值降低的现象,由于汞荧光强度是扣除空白值后得到的结果,当空白值升高时,汞荧光强度相对降低,灵敏度也相应降低。
2.3 标准溶液和质量控制样品的测定
本研究中,当硼氢化钾浓度为0.5 g/L、盐酸浓度为5 %时,仪器的灵敏度和稳定性较高。在不改变仪器参数条件下,分别测量0.25 μg/L、0.50 μg/L浓度的标准溶液及质量控制样品(编号202036)。测量结果见图2及表4。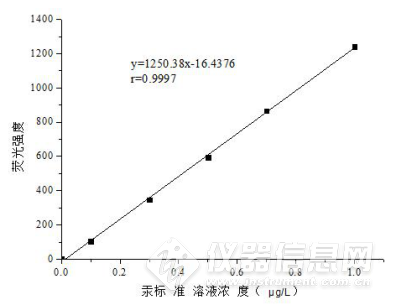
图2 汞标准曲线
表4 标准溶液及质量控制样品测量结果
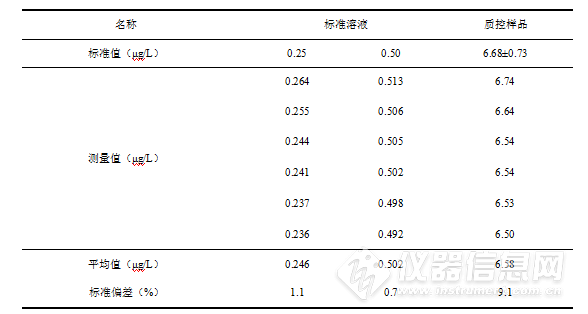
由图2可知,汞标准曲线拟合方程为y = 1250.38x - 16.4376,相关系数为0.9997,曲线的精密度较好。由表5可知,在实验确定条件下测量标准溶液和质量控制样品,数据标准偏差较小,具有较高的精密度。只有根据仪器参数条件确定最佳硼氢化钾浓度和盐酸浓度,并在测量过程中强化质量控制,才能充分发挥该方法的快速、准确的优点,提高分析的准确性和可靠性。
3 结论参考文献
魏艳红,郭建强,陈志明,等. 环境汞污染对人体健康的影响及预防措施. 大众科技,2014,3:59-61.