NIR用于不同温度下HSA与IgG结构变化研究
加热作为药物蛋白生产过程、研究药物蛋白新型复合物等过程中必需的操作,能够导致蛋白质分子变性、分解或聚集,从而影响蛋白质的活性与功能。因此,研究温度对蛋白质结构变化的影响具有较大的意义。
本课题实验选取HSA与IgG两种蛋白质为研究对象,采集不同温度下两种蛋白质的近红外光谱,并对所得的光谱进行处理与分析。利用近红外光谱对不同温度下蛋白质结构的变化进行研究。
2.1实验仪器与试剂
2.1.1 实验仪器与软件
表2-1 实验仪器与软件
| 仪器/软件 | 规格与型号 | 生产厂家 |
| 电子分析天平 | ME54E | 梅特勒-托利多仪器股份有限公司 |
| 移液枪 | 1000 μL、100 μL | 美国Thermo Fisher公司 |
| Antaris II傅里叶变换近红外(Fourier TransformNear Infrared, FT-NIR)光谱仪 | Antaris II | 美国Thermo Fisher Scientific公司 |
| 大容量吸光比色皿 | 光程1mm | 德国Hellma公司 |
| MATLAB数据处理软件 | 2015a | 美国Mathworks公司 |
2.1.2 实验材料与试剂
表2-2 实验材料与试剂
| 试剂/材料 | 规格/批号 | 生产厂家 |
| 人血清白蛋白(Albumin human) | A9731-5G | Sigma-Aldrich公司 |
| 免疫球蛋白G(IgG from human serum) | I4506-50MG | Sigma-Aldrich公司 |
2.2 NIR用于不同温度下HSA结构变化研究
2.2.1 实验方法
2.2.1.1样品的配制与光谱的采集
配制60mg/mL的HSA水溶液,进行升温处理:温度范围为45℃-80℃(45℃、50℃、55℃、58℃、60℃、62℃、65℃、70℃、75℃、80℃),采集NIR光谱,波长范围10000-4000cm-1,2cm-1分辨率,64次扫描,在各个温度下,光程长1mm,以空比色皿为背景进行扫描,同时在实验前扫描双蒸水的升温NIR光谱,供背景扣除用。每张光谱采集10次,最后进行平均处理。
2.2.1.2光谱的处理方法
(1)连续小波变换(continuouswavelet transform,CWT)
连续小波变换是一种积分变换,它具有两个参数,分别是尺度和平移。在小波基下将任意空间中的函数展开,展开后的积分变换即为连续小波变换。它具有叠加性、时移不变性、伸缩共変性、内积性、自相关性等性质。
在本实验中,为了增强光谱的分辨率,使用CWT处理原始光谱解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。
(2)主成分分析(principal component analysis,PCA)
在对数据进行处理及分析时,如果变量过多,计算过程将会十分繁琐并且计算难度大幅度提高,实验结果的获得也就十分困难,这时就需要一种数据处理方法来尽可能减少变量。主成分分析就是将多个变量中联系密切的变量通过一个新变量表现出来,将原先的变量通过尽可能少而互不相关的几个综合变量表示出来,是一种常用的多变量分析方法。
使用PCA的中心目的是将实验的数据降维,能够将光谱矩阵分解为几个向量的外积之和。本实验分别选取CWT处理后的光谱4900-4200 cm-1段、8000-5500 cm-1段,进行PCA分析,进行结果分析。
2.2.2结果与讨论
(1)60 mg/mLHSA 水溶液的近红外光谱原始图样品升温原始光谱图
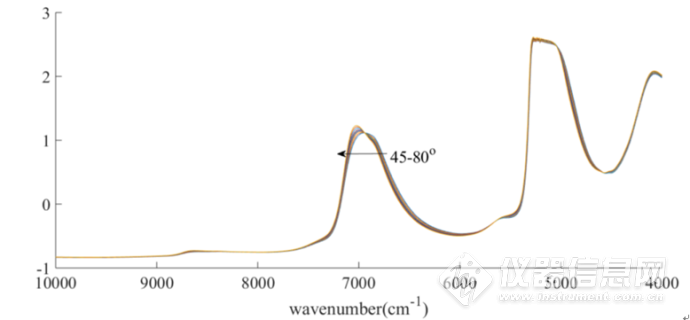
图2-1在45-80℃范围内测定的60 mg/mL HSA 水溶液的近红外原始光谱图
图2-1为在45-80℃下测定的60 mg/mLHSA水溶液的近红外光谱原始图,波数范围为10000-4000 cm-1。位于5100 cm-1O-H基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了近红外光谱仪的检测上限,因此5100cm-1附近信号在本章中弃去。本章主要分析8000-5500cm-1和4900-4200 cm-1范围内的吸收峰。从图中可以看出随着温度升高,7000 cm-1处的吸收峰发生蓝移,并且在6943 cm-1处存在一个等吸收点。该结果说明,随着温度的升高,不同结构水分子的含量也发生了相应的改变。然而,由于水分子在此波段范围内有较强的吸收,无法获得蛋白质的光谱信息。因此,为了分析HSA的结构随温度的变化,增强光谱的分辨率来获得潜在的关于HSA的光谱信息是有必要的。
(2)利用连续小波变换对原始光谱进行解析
为了增强光谱的分辨率,使用CWT处理原始光谱解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。处理结果如图2-2所示。
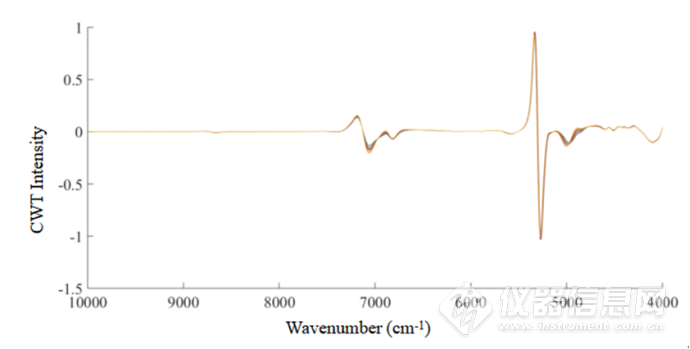
图2-2 60 mg/mL HSA水溶液在45-80℃的CWT图
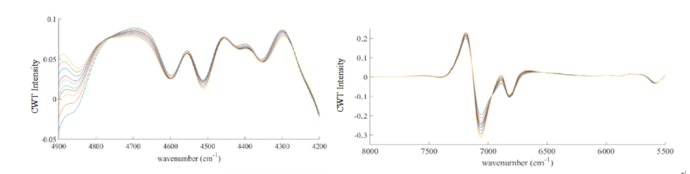
图2-3 60 mg/mL HSA水溶液在45-80℃的CWT放大图,左图为4900-4200 cm-1范围内放大图,右图为8000-5500 cm-1范围内放大图
经过小波变换之后,可以看到光谱信息得到放大,在7000cm-1左右的羟基吸收峰处,出现随着温度升高,吸光度强度明显发生变化的情况;在4900-4200cm-1酰胺吸收区域,可以明显看到4844cm-1(可归属为酰胺A/Ⅱ结构)、4597 cm-1(可归属为酰胺B/Ⅱ结构),4416 cm-1(可归属为β-折叠结构),4513 cm-1(可归属为β-折叠结构),4351cm-1(可归属为α-螺旋结构)处蛋白质的吸收峰,由此可以看出CWT处理提高了近红外光谱的分辨率,可以提取出关于HSA结构的丰富信息。在羟基吸收区域,在7070cm-1和6827cm-1处也有明显的吸收峰,并在6953cm-1和6712cm-1处有两个肩峰。
(3)4900-4200 cm-1段进行主成分分析的结果与讨论
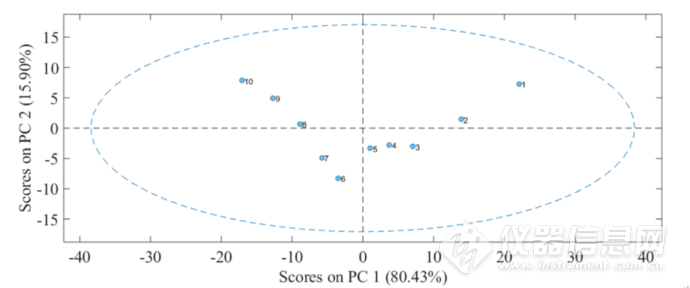
图2-4 4900-4200cm-1波段第一主成分与第二主成分得分散点图
首先对4900-4200 cm-1段谱图进行CWT处理,然后进行PCA,图2-4为第一主成分和第二主成分得分的散点图,从图中可以明显看出,在第一主成分中,1-10号样品,即45-80℃的HSA溶液的得分随着温度升高而下降;在第二主成分中,1-5号样品的得分大致呈现下降的趋势,6-10号样品呈现大致上升的趋势,并且在5-6号样品之间,即从60-62℃,得分发生明显的转折,这说明蛋白质HSA肽链骨架的构象在该温度附近发生显著的变化,而骨架构象的改变将导致二级结构的转变,进而导致蛋白质三维结构的更改,最终引起蛋白质生物活性的降低甚至是丧失。所以,从60 ℃开始,HSA结构开始发生了变化。
第一主成分数、第二主成分数、第三主成分数的累积贡献率分别是80.43%,15.90%和3.20%,总共代表了99.52%的光谱信息。如图2-5所示,a1、a2、a3为三个主成分的载荷图,b1、b2、b3为三个主成分的得分图。
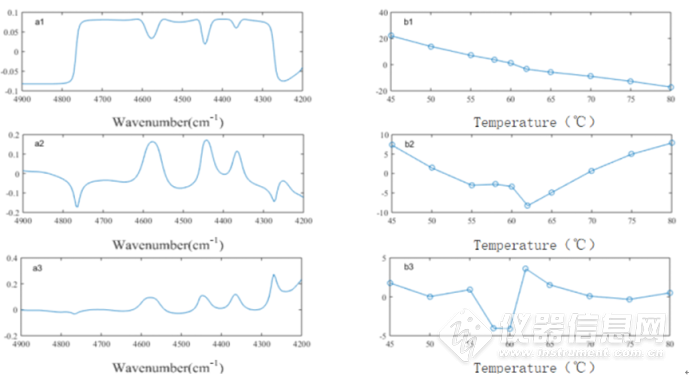
图2-5 4900-4200 cm-1段第一、第二、第三主成分的载荷图和得分图,左边a1、a2、a3为三个主成分的载荷图,右边b1、b2、b3为三个主成分的得分图
第一主成分得分与温度之间的相关系数为0.9841,第一主成分更多代表的是来自温度的影响,从散点图中的明显转折,也说明第一主成分可能包含蛋白质的信息,从第一主成分载荷图中可以看到有明显的三个吸收峰分别为4578cm-1、4443cm-1、4366cm-1,与第二主成分的吸收峰一致。
从4900-4200 cm-1段第二主成分得分图中可以看出,第二主成分所提取的光谱信息在62℃发生明显转折。此外,第二主成分还可以得到4767cm-1、4273cm-1两处吸收峰,应当对应第二主成分得分趋势的转折,这两个峰可以分别归属为酰胺A/II结构与α-螺旋结构。
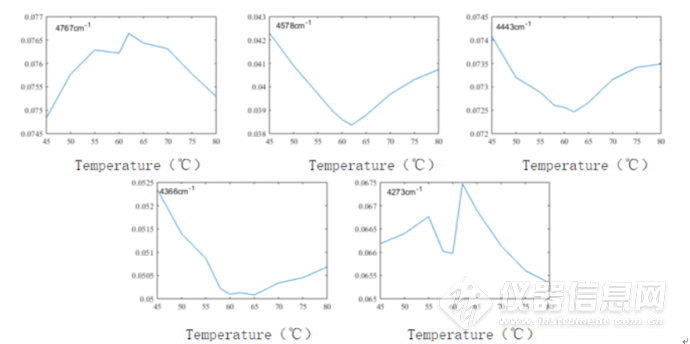
图2-6 不同温度下吸光度波数变化图,分别是4767cm-1、4578cm-1、4443cm-1、4366cm-1、4273cm-1
除4273cm-1外,其他四个波数在60℃温度左右均发生明显的吸光度的变化,这说明蛋白质肽链骨架的构象在该温度附近发生显著的改变,进一步证实了 60℃是蛋白质结构开始发生较大改变的温度这一推论的合理性。
(4)8000-5500 cm-1羟基吸收区域进行PCA处理的结果与讨论
在HSA水溶液中,HSA的结构变化可能影响周围水分子的结构,水分子也可能在HSA的结构变化中扮演着重要角色。因此,研究溶液中水分子的结构随温度的变化非常必要。
先对谱图进行CWT处理再进行PCA分析,图2-7为第一主成分和第二主成分得分的散点图,与4900-4200 cm-1范围内得到的主成分得分散点图非常相似,即在60-62℃第一主成分得分出现明显的转折点,从而可以确定水参与了HSA的热变性过程,并且在60-62℃期间,发生了水物种的变化。
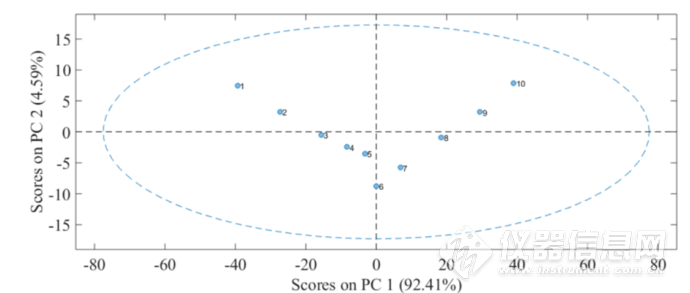
图2-78000-5500 cm-1第一主成分与第二主成分的得分散点图

图2-8第一、第二、第三主成分的载荷图和得分图,a1、a2、a3分别为三个主成分的载荷图,b1、b2、b3分别为三个主成分的得分图
如图2-8所示为三个主成分的载荷图和得分图,第一、第二、第三主成分数的累计贡献率分别为92.41%,4.59%和1.44%,总共代表了98.44%的光谱信息。从图中可以看出第二主成分所提取的光谱信息在62℃发生明显转折,第三主成分所提取的光谱信息在60-62 ℃发生明显的转折,而在7000-6500cm-1范围内主要是水的氢键结构的吸收,因此说明在60-62 ℃的温度范围内左右水发生了结构的变化。
2.3NIR用于不同温度下IgG结构变化的研究
2.3.1实验方法
配制5mg/mL的IgG水溶液,进行升温处理:温度范围为45℃-85℃(45℃、47℃、49℃、51℃、53℃、55℃、57℃、59℃、61℃、63℃、65℃、67℃、69℃、71℃、73℃、75℃、77℃、79℃、81℃、83℃、85℃),采集NIR光谱,波长范围10000-4000cm-1,2cm-1分辨率,64次扫描,在各个温度下,光程长1mm,以空比色皿为背景进行扫描,同时在实验前扫描双蒸水的升温NIR光谱,供背景扣除用。每张光谱采集3次,进行平均处理。
2.3.2结果与讨论
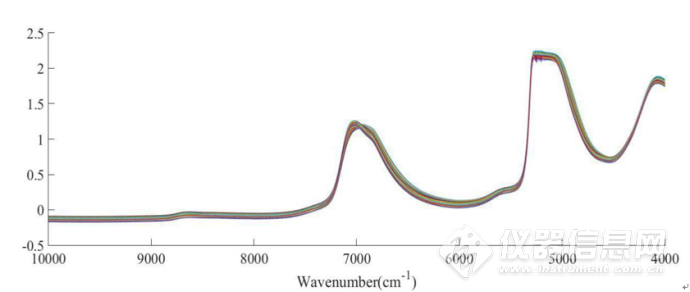
图2-9 在45-85℃范围内5mg/mLIgG水溶液的近红外原始光谱图
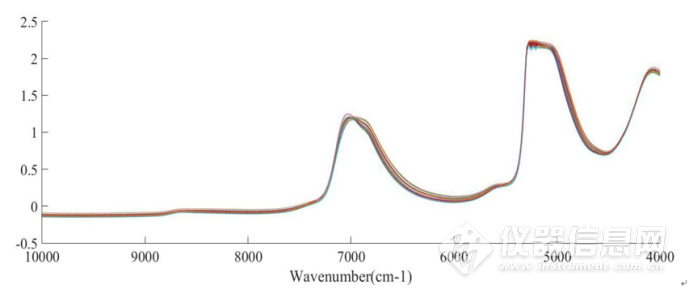
图 2-10 在45-85℃范围内5mg/mLIgG水溶液的平均光谱
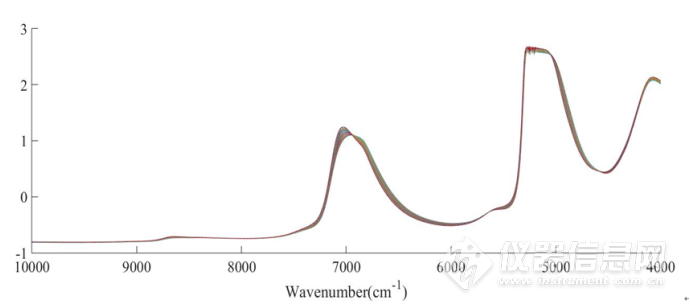
图2-11 在45-85℃范围内5mg/mLIgG水溶液平均光谱进行SNV处理后的光谱
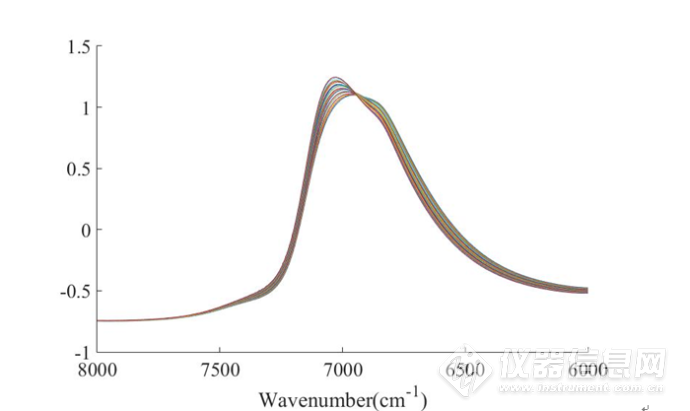
图2-12 在45-85℃范围内5mg/mLIgG水溶液平均光谱进行SNV处理后8000-6000cm-1放大光谱图
图2-9为在45-85℃下测定的5mg·mL-1IgG水溶液的近红外光谱,波数范围为10000-4000 cm-1。图2-10为平均后的光谱。图2-11是对光谱进行标准正态变换处理(SNV)后,去除基线漂移后的图谱。位于5100 cm-1O-H基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了近红外光谱仪的检测上限,因此5100cm-1附近信号弃去。本章中主要分析8000-5500cm-1和4900-4200 cm-1范围内的吸收峰。前者可归属为O-H基团对称和反对称伸缩的组合频和N-H基团伸缩振动的一级倍频;后者是N-H、C-N和C-H基团伸缩或弯曲振动的组合频或一级倍频产生的重叠峰。
从图2-11、图2-12中可以看出随着温度升高,7000cm-1处的吸收峰发生蓝移,并且在6945 cm-1处存在一个等吸收点。这表明,温度升高对体系中的水分子产生了一定的影响。然而,由于水分子在此波段范围内有较强的吸收,无法获得蛋白质的光谱信息。因此,为了分析IgG的结构随温度的变化,有必要增强光谱的分辨率来获得潜在的关于IgG的光谱信息。
为了增强光谱的分辨率,使用CWT解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。
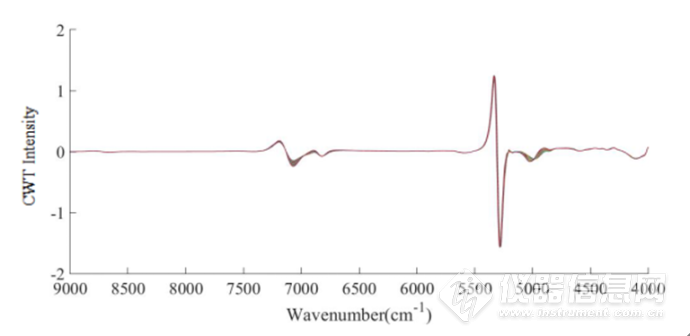
图2-13 IgG水溶液在45-85℃的CWT图
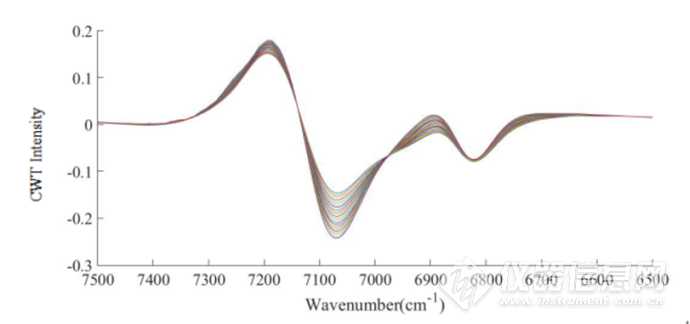
图2-14 IgG水溶液在45-85℃的7500-6500cm-1放大CWT图
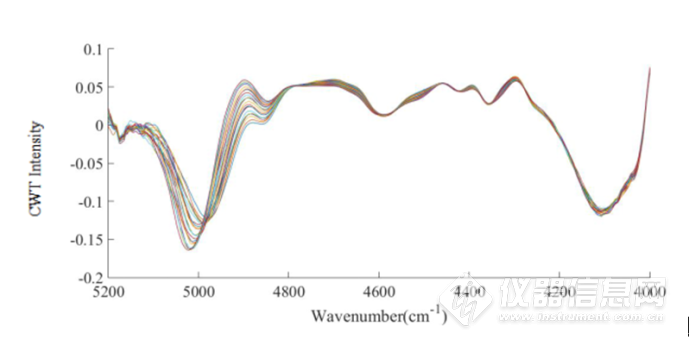
图2-15 IgG水溶液在45-85℃的5200-4900cm-1放大CWT图
经过小波变化之后,可以看到光谱信息得到放大,在7000cm-1左右的羟基吸收峰处,出现随着温度升高,吸光度经小波变换后的强度发生了不同的变化,在4900-4200cm-1酰胺吸收区域,可以明显看到4900 cm-1、4650 cm-1,4520 cm-1,4380 cm-1,4300cm-1蛋白的吸收峰,可以看出CWT对近红外光谱的分辨率进行了提高,可以提取出关于IgG结构的丰富信息。
(1)4900-4200cm-1段进行PCA的结果与讨论
首先对4900-4200cm-1段的光谱进行CWT处理,然后进行PCA分析。
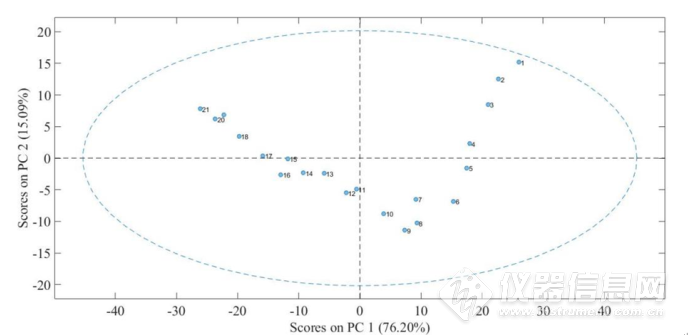
图2-16 IgG水溶液在4900-4200cm-1的第一主成分和第二主成分得分的散点图.其中,1-21号样品分别对应温度为:45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85℃
图2-16所示为IgG水溶液在4900-4200cm-1第一主成分和第二主成分得分的散点图。由图可知,在第一主成分中,1-21号样品的IgG溶液随着温度升高,得分的绝对值大致呈现下降的趋势。而对于第二主成分,1-9号,即45-61℃样品得分呈现下降趋势,经过9号处转折,9-21号,即61-85℃样品得分大致呈现上升趋势。并且,实验过程中,在65℃样品状态发生改变,即产生肉眼可见的白色浑浊,随温度上升,样品浑浊程度变大。综上,这说明蛋白质肽链骨架的构象在61℃附近发生结构上的变化,但是在65℃发生了显著的变化—该变化导致蛋白质发生沉淀。所以,61 °C可能预示着蛋白质IgG变性的开始,而65℃即蛋白质IgG在水溶液中发生沉淀的温度。
图2-17所示为IgG水溶液在4900-4200cm-1第一主成分的载荷图,从第一主成分的载荷图中可以看出4760-4600cm-1处、4540-4450cm-1、4400-4360cm-1、4330-4260cm-1处的峰包含有更多关于蛋白质结构更多的信息,在蛋白质结构中,C-H基团,其第一组合频大约在5000-4160cm-1,在该谱带间,谱带的信号较强,因此,该段谱带的主成分分析对于蛋白质结构变化的研究具有较大的意义。图2-18 为IgG水溶液在4900-4200 cm-1第一主成分的得分图,从图2-18中,可以看出,第一主成分的得分与温度呈现较好的线性关系,对其进行线性回归计算可得如图2-19的回归线,R2=0.9956,故可以认为第一主成分与温度具有很好的相关性,因此可以利用第一主成分来预测温度。
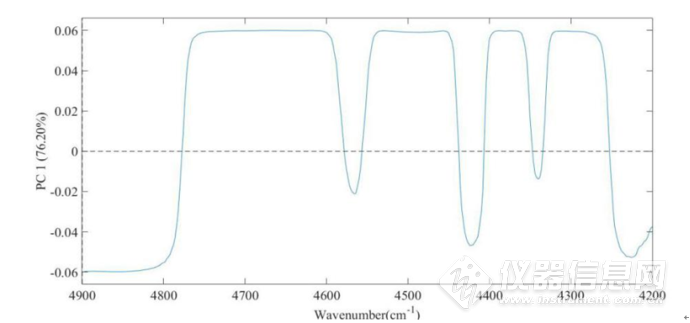
图2-17 IgG水溶液在4900-4200cm-1第一主成分的载荷图
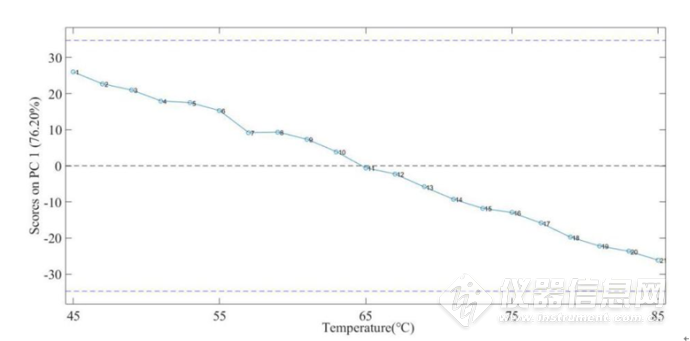
图2-18 IgG水溶液在4900-4200cm-1第一主成分的得分图
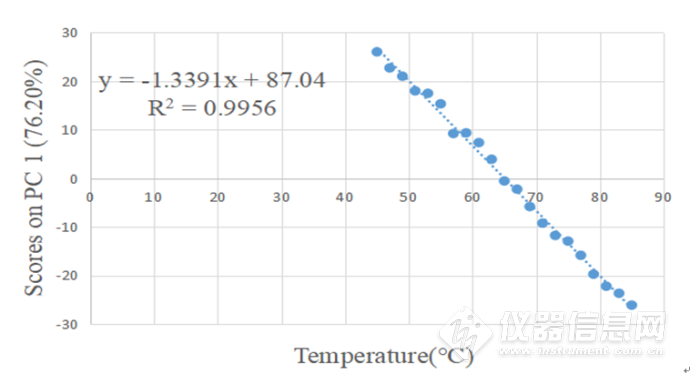
图2-19 IgG水溶液在4900-4200cm-1第一主成分的得分图的线性回归曲线
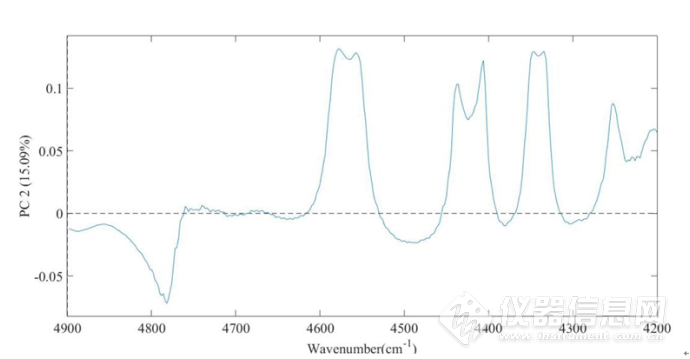
图 2-20IgG水溶液在4900-4200cm-1第二主成分的载荷图
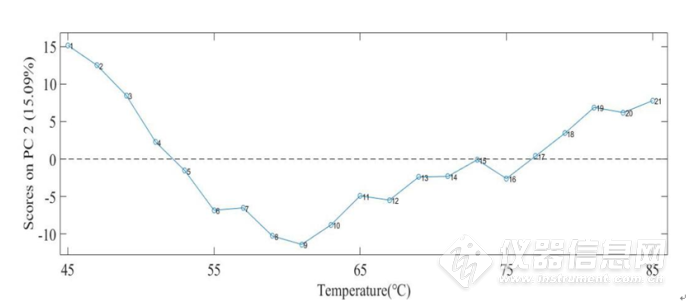
图 2-21 IgG水溶液在4900-4200cm-1第二主成分的得分图
1-21号分别对应45-85℃样品,从第二主成分得分图中可以看出,8-10号样品,即59℃、61℃、63℃得分发生了明显的转折,即主成分二所提取的光谱信息在61℃发生明显转折。在4900-4200cm-1酰胺吸收区域,包含有蛋白质的酰胺A/Ⅱ结构、酰胺B/Ⅱ结构,β-折叠结构与α-螺旋结构,该波段范围内蛋白质的相应结构的吸收峰随温度的改变发生了明显的变化,这表明蛋白质的结构在该温度附近发生了改变。
(2)8000-5500cm-1羟基吸收区域PCA的结果与讨论
IgG的结构变化对周围水分子的结构有一定的影响作用,从该段谱图主要分析水分子的结构变化,通过水分子结构随温度的变化来推断蛋白质的结构变化。
首先对8000-5500cm-1羟基吸收区域进行CWT处理后再进行PCA分析,图2-22为第一主成分和第二主成分得分的散点图,与4900-4200cm-1范围得到的主成分得分散点图的得分正负及趋势上具有一些不同之处。在第一主成分中:1-21号样品的得分大致呈现上升的趋势;在第二主成分中,1-6号样品,即45-55℃样品的得分大致呈现较好的上升趋势,而在57℃明显下降,而在4900-4200cm-1的第一主成分及第二主成分散点图中57℃并非为异常点,推测其原因是由于在57℃时,水的O-H键结构发生了较大的改变;在61℃时,得分发生了较小程度的下降,亦可以推测在61℃蛋白质结构发生了改变,而在65℃时,得分发生了较大程度的下降,且在65℃时,样品产生了较为明显的白色浑浊,因此,第二主成分的得分也可以较为直接的表明蛋白质结构和蛋白质状态的变化。
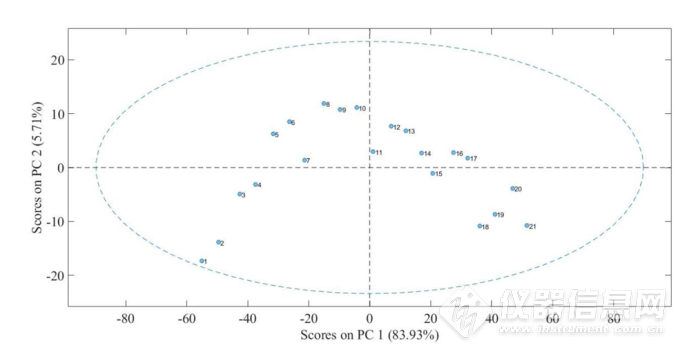
图2-22 IgG水溶液在8000-5500cm-1的第一主成分和第二主成分得分的散点图.其中,1-21号样品分别对应温度为:45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85℃

图2-23 IgG水溶液在8000-5500cm-1第一主成分的载荷图
从图2-23中可以看出,在7000-6550 cm-1、6000-5950 cm-1、5940-5800 cm-1、5750-5600 cm-1内水的结构变化与温度的改变具有一定的关系,因此,提取8000-5500 cm-1范围内进行分析具有意义。并且从图2-24可以看出,IgG水溶液在8000-5500cm-1的第一主成分的得分与温度呈现较好的线性关系,因此利用第一主成分预测温度较为合理。
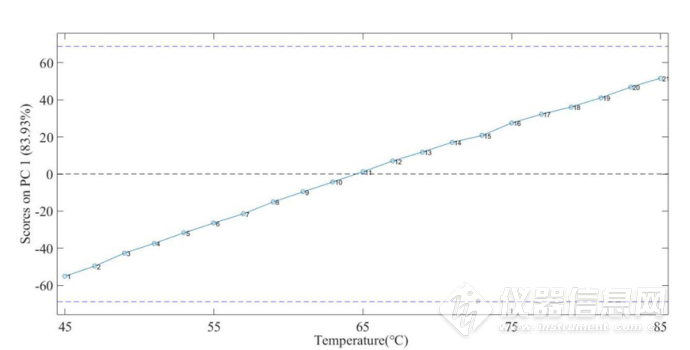
图2-24IgG水溶液在8000-5500cm-1第一主成分的得分图
2.4结论
本文应用了近红外光谱分析技术在蛋白质分子结构中检测的快速、高灵敏性、无损性等特点,研究了HSA与IgG在温度的变化条件下的结构变化。从近红外光谱中探究微观的分子结构的变化,温度升高对溶液体系中水分子的结构产生了一定的影响,改变了蛋白质的结构,在水溶液中,60 mg/mL HSA的结构在60℃左右发生显著的变化。5 mg/mLIgG水溶液中的IgG在61 ℃左右发生结构上的变化,并且在65 ℃产生了沉淀,在近红外光谱上有所体现。说明近红外光谱能够表征蛋白质细微的结构变化,在生产工艺流程中,能够为追踪蛋白质的活性变化提供一定的帮助。
参考文献
桂萍,罗永康,冯力更.加热温度对混合肉肌原纤维蛋白质结构的影响.中国农业大学学报,2018,23(05):93-101.

























