灭螨醌是一种人工合成的触杀型杀螨剂,并兼具摄入毒性。作用机理是由灭螨醌水解产物羟基灭螨醌作用于线粒体的电子传递过程,抑制线粒体的呼吸作用[1]。由于其低毒性、无内吸性、并对多种螨虫的卵、幼虫、若虫均有灭杀效果,广泛运用于果蔬类农作物的螨虫防治。各国对灭螨醌的最大残留量都出台了严格规定,以灭螨醌及其代谢产物羟基灭螨醌的总和表示。2021年出版的中国国家标准GB 2763-2021中灭螨醌最大残留限量为0.01mg/kg[2]。欧盟还对动物源食品中的灭螨醌最高残留水平作出了规定:牛奶、肉、蛋:0.01mg/kg、蜂蜜:0.05 mg/kg[3]。美国环保署对牛、羊、马肉及其制品限定在:0.02mg/kg[4],加拿大:山羊肉、马肉、牛肉、牛奶灭螨醌最大残留限量:0.02mg/kg[5]。国际上对动物源食品中灭螨醌的农药残留愈发关注,但相关研究报道还很少。研究多集中在植物源食品中:HPLC-DAD检测LC-MS辅助定性[6]、HPLC-PLD检测法[7]、HPLC-UV检测法[8]。Xiaohong Ying等[9]报道了UHPLC-MS技术检测牛肉、鸡肉、鱼中的灭螨醌与羟基灭螨醌,该方法运用APCI源进行离子化。本次研究旨在探究ESI源下液质联用法检测灭螨醌与羟基灭螨醌的方法,为其扩展至多农残扫描建立基础。
一.4 样品前处理
准确称取试样5g至50mL具塞塑料离心管中,加入5uL甲酸溶液,涡旋混匀,再加入0.1%甲酸甲醇溶液20mL,涡旋振荡5min,10000r/min冷冻离心5min。转移上清液,再向残渣中加入12mL0.1%甲酸甲醇,涡旋振荡5min,10000r/min冷冻离心5min,转移合并两次上清液,继续用12mL0.1%甲酸甲醇重复提取残渣,合并上清,用0.1%甲酸甲醇溶液定容至50mL。吸取2mL提取液与1mL水混合,加入预先活化好的C18小柱,自然流尽,压干弃去流出液,用9mL0.1%甲酸甲醇洗脱,收集流出液,氮气吹干,1mL0.1%甲酸甲醇复溶,过0.22μm尼龙滤膜,供液相色谱-串联质谱仪测定。(前处理过程中要做好避光处理)
一.5 液相色谱与质谱条件
一.5.1 色谱条件:
色谱柱:ACQUITY UPLC® BEH Phenyl 2.1x100mm 1.7um反相色谱柱,柱温:35℃。流动相:A为10mmol/L甲酸铵溶液(含0.1%甲酸),B为0.1%甲酸甲醇。洗脱比例:0~0.5 min 85% B,0.5~4.0 min 85%~90% B,4.0~4.5 min 90%~98% B,4.5~7.5 min 98% B,7.5~7.6 min 98%~85% B,7.6~12 min 85% B流速:0.3mL/min。进样量:2μL。
一.5.2 质谱条件:
离子源:带喷射流的电喷雾离子源(AJS ESI源),离子化方式:正离子模式,干燥气温度:280℃,干燥气流量:10L/min,雾化气压力:20psi,鞘气温度:280℃,鞘气流量:11L/min,毛细管电压:5000V,喷嘴电压:500V,扫描方式:多反应监测(MRM),Delta EMV(+):200。
2 结果与讨论
2.1质谱条件优化
Xiaohong Ying等[9]报道灭螨醌与羟基灭螨醌经高能粒子碰撞后会产生189.1[M+H-C11H24]+,171[M+H-C11H24-H2O]+,115[M+H-C11H24-CO-H2O-CO]+等特征离子碎片。用0.1%甲酸水/甲醇(1:1,V:V)的溶液配制浓度为500ng/mL的标准品溶液,对灭螨醌和羟基灭螨醌的质谱条件进行优化。羟基灭螨醌观察到343.3的[M+H]+分子离子峰,灭螨醌标准品也出现343.3的分子离子峰,两种标准品进行子离子扫描均可获得189.0、171.0、115.0等特征碎片离子峰。原因是灭螨醌在离子化的过程中乙酰氧基上的C-O键发生断裂,失去一个[C2H3O]基团,O原子上的孤电子对跟[H2+]结合,形成新的分子离子基团,结构上与离子化后的羟基灭螨醌相同。
Peter JW Stone等[10]报道了灭螨醌402.3[M+NH4]+的氨基加和分子离子峰。往0.1%的甲酸水中添加一定量的甲酸铵,配制成10mmol/L甲酸铵水溶液含0.1%甲酸/甲醇(1:1,V:V)稀释标准品溶液,对灭螨醌和羟基灭螨醌进行母离子与子离子的扫描。羟基灭螨醌的母离子与子离子没有发生改变,灭螨醌新增了[M+NH4]+的分子离子峰402.3,特征碎片离子峰为343.3、189.0、171.0。改变干燥气温度与鞘气温度由200℃升高至300℃,灭螨醌[M+NH4]+离子的响应呈现衰减的趋势,羟基灭螨醌[M+H]+离子的响应呈现增强的趋势,见图1。综合两种化合物的响应值大小考虑,选择280℃作为干燥气温度和鞘气温度。最终选取m/z402.3/343.3作为灭螨醌的定量离子对m/z402.3/189.0作为定性离子对,羟基灭螨醌的定量定性离子对分别为m/z343.3/189.0、m/z343.3/171.0,优化后的质谱参数见表1,MRM色谱图见图2。
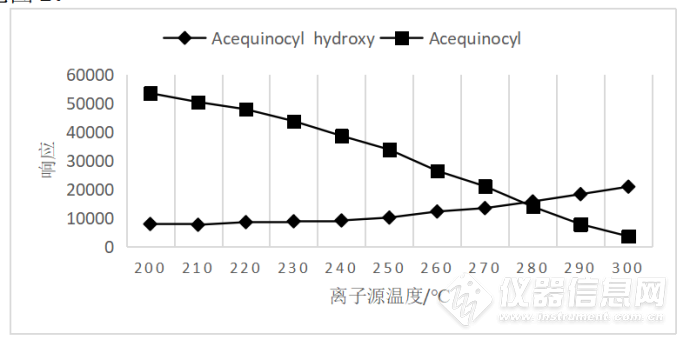
图1 源温变化对灭螨醌和羟基灭螨醌离子化响应的影响
表1 灭螨醌和羟基灭螨醌的质谱参数
化合物 |
离子对 |
母离子 |
子离子 |
Fragmentor |
CE |
池加速电压 |
|
|
(m/z) |
(m/z) |
(V) |
(V) |
(V) |
灭螨醌 |
定量 |
402.3 |
343.3 |
104 |
13 |
4 |
|
定性 |
402.3 |
189.0 |
104 |
33 |
4 |
羟基灭螨醌 |
定量 |
343.3 |
189.0 |
128 |
25 |
4 |
|
定性 |
343.3 |
171.0 |
128 |
37 |
4 |
2.2液相条件优化
灭螨醌与羟基灭螨醌如图2 所示都带有一个萘醌和一个十二烷基基团,加之灭螨醌也会产生343.3/189.0,343.3/171.0两组与羟基灭螨醌相同的离子对,液相上需要对两种化合物实现基线分离。与C18柱相比BEH Phenyl柱对灭螨醌和羟基灭螨醌拥有更好的分离能力,能够更快的实现基线分离,并获得更好的峰形。流动相的选择上,甲醇比乙腈的分离度、峰形都要更好。优化洗脱梯度后灭螨醌和羟基灭螨醌MRM色谱图如图3所示峰形良好。
图2 灭螨醌(左)、羟基灭螨醌(右)结构图

图2 灭螨醌(RT:3.74min)、羟基灭螨醌(RT:2.99min)MRM色谱图
2.3前处理探讨
本次试验选取了动物源基质常用的甲醇、乙腈作为提取溶剂,有报道[11]指出灭螨醌在弱酸性条件下保有良好的稳定,但在光照下的水溶液中会快速分解。故此,向提取溶剂中加入体积比为0.1%的甲酸,并在避光条件下进行前处理实验。结果显示乙腈(含0.1%甲酸)作为提取溶液的目标物响应值只有甲醇(含0.1%甲酸)的70%左右。同时比较了C18、HLB、中性氧化铝三种净化小柱,对样品基质的净化效果。对比净化前后的响应值发现,灭螨醌的响应值:C18柱净化提升了约34%,HLB降低了约19%,中性氧化铝柱降低了约22%;羟基灭螨醌的响应值:C18柱净化提升了约5%,HLB降低了约11%,中性氧化铝柱降低了约80%。结果表明甲醇(含0.1%甲酸)提取,C18小柱净化更加适用于测定牛乳基质中的灭螨醌和羟基灭螨醌。
2.4标准基质工作曲线、检测低限、准确度、精密度
为了更好的消除基质效应对实验结果的影响,使用经前处理后的空白基质液配制线性范围0.5~20.0ng/mL的标准基质工作曲线。对空白样品进行加标试验,运用安捷伦的Auto-RMS方式计算信噪比,灭螨醌加标浓度为0.5μg/kg时,S/N为:12.3、14.6、11.0>10;羟基灭螨醌加标浓度为2.5μg/kg时,S/N为:13.5、13.0、15.2>10。得到灭螨醌检测低限为0.5μg/kg、羟基灭螨醌检测低限为2.5μg/kg。计算线性回归方程、相关系数结果如表2。
表2 灭螨醌和羟基灭螨醌线性回归方程、相关系数、检测低限
化合物 | 线性范围 (ng/ml) | 线性方程 |
相关系数
(R2) | 检测低限 (μg/kg) |
灭螨醌 | 0.5~20.0 | y = 100.805242 * x + 5.342976 | 0.9990 | 0.5 |
羟基灭螨醌 | 0.5~20.0 | y = 49.206356 * x + 6.602473 | 0.9993 | 2.5 |
对空白牛乳样品进行灭螨醌和羟基灭螨醌:5.0μg/kg、10μg/kg、50μg/kg三个浓度6组平行的加标实验,结果如表3所示,本方法的准确度和精密度良好。
表3 牛乳样品中灭螨醌和羟基灭螨醌的准确度、精密度
| 灭螨醌 | | 羟基灭螨醌 | |
加标浓度 (μg/kg) | 准确度 平均回收率/% | 精密度 RSD/% | 准确度 平均回收率/% | 精密度 RSD/% |
5.0 | 92.6 | 7.9 | 95.3 | 6.4 |
10 | 91.2 | 4.1 | 91.5 | 6.2 |
50 | 93.6 | 9.5 | 94.1 | 6.4 |
3 结论
建立了超高效液相色谱-质谱法检测牛乳中的灭螨醌和羟基灭螨醌残留量的方法。灭满醌检测低限0.5μg/kg,羟基灭螨醌检测低限2.5μg/kg。5.0μg/kg、10μg/kg、50μg/kg三梯度加标平均回收率:91.2%~95.3%,RSD:4.1%~9.5%。方法前处理操作简单、检测灵敏度高、回收精密度好,满足各国对灭螨醌的限值要求。
参考文献:
[1] Yoko KOURA, Sachiko KINOSHITA, Kiyoshi TAKASUKA, et al. Respiratory Inhibition of Acaricide AKD-2023 and Its Deacetyl Metabolite[J]. Journal of Pesticide Science, 1998, 23 (1):18-21
[2] GB 2763-2021 食品安全国家标准食品中农药最大残留限量,中国农业出版社,2021-03-03
[3] COMMISSION REGULATION (EU) 2021/2202, Official Journal of the European Union, 14 December 2021.
(https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=uriserv%3AOJ.L_.2021.446.01.0008.01.ENG&toc=OJ%3AL%3A2021%3A446%3ATOC)
[4] Acequinocyl; tolerances for residues, U.S. Environmental Protection Agency, 15 June 2011.
(https://www.ecfr.gov/current/title-40/chapter-I/subchapter-E/part-180/subpart-C/section-180.599)
[5] Maximum Residue Limits for Pesticides, Health Canada, 8 May 2009。
(https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=uriserv%3AOJ.L_.2021.446.01.0008.01.ENG&toc=OJ%3AL%3A2021%3A446%3ATOC)
[6] PIERLUIGI CABONI, et al. Determination of Acequinocyl and Hydroxyacequinocyl on Fruits and Vegetables by HPLC-DAD, J. Agric. Food Chem, 2004, 52(22):6700-6702
[7] 曾铭,蒋小良,喻零春,苏淑坛.高效液相色谱法测定水果中的灭螨醌和羟基灭螨醌[J].化学分析计量,2017,26(02):44-47.
[8] 陈波,徐明敏,金米聪.水果中灭螨醌和羟基灭螨醌残留的高效液相色谱法测定[J].中国卫生检验杂志,2017,27(05):622-625.
[9] Xiaohong Ying, Heyong Cheng, Xin Hao,et al. Determination of Acequinocyl and Hydroxyacequinocyl Residues in Food by Ultra-High Performance Liquid Chromatography, Food Anal. Methods, 2015(8):578-585
[10] Peter JW Stone,Jennifer,Hitchcock,Jean-Francois,Roy,Christophe Deckers.加利福尼亚州消遣用大麻法规中规定的农药和真菌毒素的测定,安捷伦应用简报
(LCMSms-5994-0648zh-cn-agilent.pdf]https://www.agilent.com.cn/cs/library/applications/application-pesticides-cannabis-california-regulations-mycotoxins-LCMSms-5994-0648zh-cn-agilent.pdf[/url])
[11] PMRA (ERC2007-10) Acequinocyl, Health Canada ,19 November 2007
(https://health.canada.ca/en/health-canada/corporate/request-publication-form.html?title=PMRA%20(ERC2007-10)%20Acequinocyl)




