推荐厂家
暂无
暂无





[b][size=10.5pt][font=微软雅黑]药物载体控释系统:[/font][/size][size=10.5pt][font=微软雅黑]控制药物释放[/font][/size][/b][size=10.5pt][font=微软雅黑]是八十年代发展起来的一种新技术,是药物学发展的一个新领域。[/font][/size][b][size=10.5pt][font=微软雅黑]药物控制释放体系是将药物包埋于某种聚合物辅料中,由于不同辅料和制备工艺限制药物的溶出和扩散速度,通过聚合物的溶蚀和水解将药物缓慢、持续稳定地释放出并发挥作用。[/font][/size][/b][size=10.5pt][font=微软雅黑]设计药物缓释制剂的目的:[/font][/size][size=10.5pt][font=微软雅黑] 一是尽可能地延长药物的作用时间或达到所期望长的作用时间;[/font][/size][size=10.5pt][font=微软雅黑] 二是减小给药后即刻出现的局部组织或血药浓度过高和潜在的毒性。[/font][/size][size=10.5pt][font=微软雅黑]低分子量的药物由于相对分子质量小,易从人体中排泄出去,为了维持一定的血药浓度,往往采用多次给药的方法,这样易使药物在体内的浓度出现“峰谷”现象,当药物浓度处于“峰值”有可能引起毒副作用,处于“波谷”时有又可能低于有效浓度,从而影响疗效。[/font][/size][size=10.5pt][font=微软雅黑]因此,要使药物具有疗效,必须使血液中的药物浓度即血药浓度达到一定标准-最低有效浓度。正常的用药剂量应能使血药浓度维持在最低浓度与中毒极限浓度之间。[/font][/size]
最新发现与创新 中国科技网讯 南开大学药物化学生物学国家重点实验室在药物传输载体研究方面取得重要进展,其研究成果“基于蛋白—多肽特异性结合的小分子水凝胶”,近日发表在《德国应用化学》上。 据课题组介绍,药物传输是实现药物疗效不可或缺的重要环节。利用现代生物化学技术开发的新型多肽/蛋白质、抗体、疫苗及基因等新型药物在环境及人体内极易失活和降解,从而导致生物利用度低。而先进的药物载体和传输技术是提高药物的生物利用度、增加药物疗效、降低其毒副作用和改善病人耐受性的主要手段。从20世纪90年代开始,外表类似果冻的小分子水凝胶作为一种新颖的生物材料,在药物传输方面展现了良好的应用前景。如何在温和条件下制备水凝胶用于药物传输,一直是科学家力求达到的目标。 南开大学杨志谋、龙加福教授课题组结合各自在相应研究领域的积累,提出利用蛋白质和多肽特异性结合的特点制备新型蛋白—多肽杂化水凝胶。该体系利用蛋白—多肽的特异性结合来增强多肽自组装纤维之间的结合力,从而形成三维网络结构以及形成性质更为优异的水凝胶。他们针对抗肿瘤药物、多肽/蛋白质药物及基因药物,重点以嵌段共聚物、超分子化合物、小分子凝胶及高分子水凝胶等材料为基础,研发出生物相容性高的可注射局部药物传输系统。该类新型药物传输系统由蛋白质和多肽组成,生物相容度高。 同时,该类水凝胶能包裹各类药物,可局部注射于病灶,起到局部长期缓释药物的效果,提高病人耐受性,减轻毒副作用。(通讯员 周兴龙 韦承金 记者 冯国梧) 《科技日报》(2012-7-15 一版)

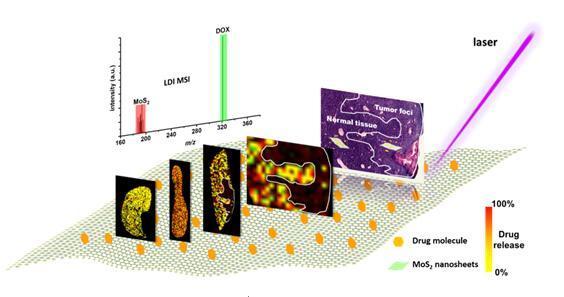
纳米药物载体研究进展齐云龙http://ng1.17img.cn/bbsfiles/images/2012/12/201212262348_415894_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212262348_415895_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212262349_415896_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212262349_415897_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212262349_415898_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212262349_415899_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212262349_415900_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212262349_415901_1705310_3.jpg

 留言咨询
留言咨询

 400-860-5168转3698
400-860-5168转3698
 留言咨询
留言咨询

 留言咨询
留言咨询


