

老化验工
第5楼2009/06/04
里面的游离氯微乎其微,可以忽略,请看下面的定量计算:
氯气与氢氧化钠的反应涉及到一个氧化还原歧化反应(平衡常数可以计算,示为KO-R)和两个中和反应。生成次氯酸+盐酸的反应及常数如下

平衡常数是根据标准电极电位计算的。
氯气与氢氧化钠反应及其平衡常数为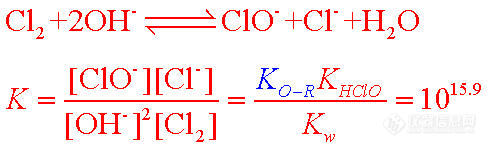
溶液中应该满足关系:C(Cl)= C(ClO),当溶液的pH=10.0,令C(Cl)=1.0 mol/L时,游离氯气的浓度仅为10-7.9mol/L。这样低的浓度还能说有游离氯吗?
有效氯应该是指次氯酸钠中具有氧化性的含氯物质,用于衡量其氧化力,但由于次氯酸钠中的游离氯可以忽略,因而有效氯实际上就是次氯酸根部分,按规定仍按元素氯来表示,而游离氯是指以氯单质形式存在的那部分氧化性物质,也按元素氯来表示。因为表示方法相同,概念上容易产生混淆。
自制的次氯酸钠,因含氯化钠,酸化后,立即产生游离氯,反应1强烈偏向左边。平衡常数很能说明问题(只含次氯酸钠的化学试剂,如果加盐酸酸化,情况同上)。
加热次氯酸钠溶液时,有两种可能:分解产生氧气和氯化钠,分解产生氯酸钠和氯化钠(用热碱吸收氯气发生的反应)。我认为基本发生第二个反应。
游离氯都可以忽略了,就谈不上测定它了。
老化验工
第9楼2009/06/04
含与不含是可以计算说明的,化学平衡可以定量计算不同条件下的某成分浓度,“绝对含有”这话严格讲是对的,但人们对“有与没有”也是有规定的,定量分析规定,当溶液中某成分的浓度低于10-6mol/L时,可视为已反应完,如果计算不算数的话,看来只需要定性分析了。游离氯与次氯酸根的转化受到PH值的调控,如果溶液呈碱性,游离氯的浓度是非常低的。如果认为酸化会产生氯气就认定有游离氯的话,那肯定是应有考虑平衡移动的问题。
关于化学平衡中的计算问题,用到组合平衡常数的导出,用到弱酸碱平衡中的分布分数,还用到氧化还原平衡中的常数与标准电极电位的关系。
如果不认可定量计算结果的话(除非是计算有误),分析化学也就失去了对化验的理论指导意义。
老化验工
第10楼2009/06/04
再给一个次氯酸钙的计算结果,设次氯酸钙浓度为0.50mol/L,次氯酸根为1.0mol/L(为了计算上的方便,设此值)。次氯酸根作为共轭碱讨论,其碱离解常数为Kb=10-6.47,计算PH值时,可以按弱碱的最简式计算,即
[OH-]=(cKb)0.5=10-3.23mol/L,
pOH=3.23, pH=10.77,
可见,次氯酸钙溶液水解后呈弱碱性,在前面帖子的计算中,我为了计算方便,设PH为10,其结论基本可适用于次氯酸钙的情况,当然,用纯次氯酸钙溶液来讨论时,溶液中的氯离子浓度极低,若用第一个化学平衡来分析,即生成氯气的平衡,右边的氯离子极少,平衡更应该强烈偏向右边。氯气就更少了。