

第一节滴定分析法概述
lilongfei14
第1楼2011/11/18
酸碱滴定法
配位滴定法(络合滴定法)
氧化还原滴定法
沉淀滴定法
非水溶液滴定
(2)按滴定方式分类
直接滴定法: 如强酸滴定强碱
间接滴定法:如氧化还原法测定钙
返滴定法:如配位滴定法测定铝
置换滴定法:
3、滴定分析法特点
①用于组分含量在1%以上的常量组分的分析;
②快速、简便、准确度高(相对误差<0.2%);
③应用范围广。
二、滴定反应对化学反应的要求和滴定方式
1、滴定反应对化学反应的要求
①反应必须定量进行,反应完全的程度达到99.9%以上;
②反应必须迅速完成,对速度慢的反应有加快措施;
③反应必须按一定的反应式进行,反应具有确定的化学计量关系,且无副反应发生;
④有合适的确定滴定终点的方法。
2、滴定的主要方式
①直接滴定法:利用标准溶液直接滴定待测物质。
②返滴定法(回滴定法):在待测试液中准确加入适当过量的滴定剂(标准溶液),待反应完全后,再用另一种标准溶液返滴剩余的第一种标准溶液。
用盐酸测定固体碳酸钙
返滴定法特点:用于反应速度慢或反应物是固体,加入滴定剂后不能立即定量反应或没有适当指示剂的滴定反应。
③置换滴定法:先加入适当的试剂与待测组分定量反应,生成另一种可被滴定的物质,再用标准溶液滴定反应物。用于不按确定的反应式进行(伴有副反应)反应的物质。
lilongfei14
第2楼2011/11/18
例如:Na2S2O3与K2Cr2O7反应。
④间接滴定法:被测定组分不能与标准溶液直接反应时,将试样通过一定的反应后,再用适当的标准溶液滴定反应物。
例如:KMnO4测定Ca2+。
三、标准溶液与基准物质
1、基准物质(standard substance)
基准物质:直接配制或标定标准溶液的物质。
基准物质应具备下列条件:
①纯度高,一般要求在99.9%以上,杂质总含量小于0.1%;
②组成与化学式相符,包括结晶水;
③性质稳定,在空气中不吸湿,加热干燥时不分解,不与空气中的二氧化碳、氧气等作用;
④易溶解;
⑤具有较大的摩尔质量,以减少称量误差。
常用的基准物质
名称 | 化学式 | 使用前的干燥条件 |
碳酸钠 | Na2CO3 | 270-300℃干燥2-2.5h |
邻苯二甲酸氢钾 | KHC8H4O4 | 110-120℃干燥1-2h |
重铬酸钾 | K2Cr2O7 | 100-110℃干燥3-4h |
草酸钠 | Na2C2O4 | 130-140℃干燥1-1.5h |
氧化锌 | ZnO | 800-900℃干燥2-3h |
氯化钠 | NaCl | 500-650℃干燥40-45min |
硝酸银 | AgNO3 | 在浓硫酸干燥器中干燥至恒重 |
lilongfei14
第3楼2011/11/18
例题:
T KMnO4 /Fe = 0.007590g/mL
表示1mL KMnO4标准溶液相当于0.007590g Fe。
m Fe = T Fe / KMnO4 ×V KMnO4
3、标准溶液的配制
(1)直接法
在分析天平上准确称取一定量已干燥的基准物质,溶解后定量转移到已校正的容量瓶中,用蒸馏水稀释至刻度,充分摇匀。
(2)标定法
标定(standardization):用基准物质或已知准确浓度的溶液来确定标准溶液浓度的操作过程。
直接标定(用基准物质进行标定):准确称取一定量的基准物质,溶于水后用待测的标准溶液滴定,直至反应完全。
间接标定:用另一已知浓度的标准溶液标定待测的标准溶液。
比较:用基准物直接标定标准溶液的浓度后,采用比较法进行验证。
(3)标准溶液配制一般规定
①制备标准溶液用水应符合GB6682中三级水的规格;
②所用试剂的纯度应在分析纯以上;
③所用分析天平的砝码、滴定管、容量瓶及移也液管均需定期校正;
④标定标准溶液的实际为基准试剂,制备标准溶液的试剂为分析纯以上试剂;
⑤制备标准溶液的浓度系指20℃时的浓度,在标定和使用时,若温度有异,须校正。
⑥“标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作做4次平行测定,每人4次平行测定结果的极差与平均值之比≤0.1%,结果取平均值,浓度值取4位有效数字。
⑦凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中任何一种,且两种方法测得的浓度值之差≤0.1%,以标定结果为准;
几点说明:
①标准溶液由专人负责配制、标定;
②标准溶液要定期标定。
(4)配制溶液注意事项
lilongfei14
第5楼2011/11/18
①所用的溶液应用纯水配制,容器应用纯水洗3次以上。
②溶液用带塞的试剂瓶盛装;见光易分解的溶液要装在棕色瓶中;挥发性试剂配制的溶液,瓶塞要严密;见空气易变质及放出腐蚀性气体的溶液要盖紧,长期存放时要蜡封;浓碱液用塑料瓶装,如装在玻璃瓶中,要用橡皮塞塞紧。
③每瓶试剂溶液必须标明名称、规格、浓度和配置日期的标签。
三、酸碱指示剂
1、指示剂的变色原理及变色范围
酸碱指示剂(acid-base indicator):一般是弱的有机酸或有机碱,它们在溶液中或多或少地离解成离子。因其分子和离子具有不同的结构,因而具有不同的颜色。
例如:酚酞是一种弱酸,它在溶液中存在如下离解平衡:
HIn H+ + In-
无色(酸式) 红色(碱式)
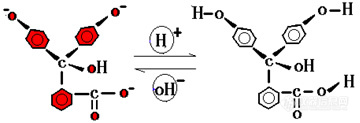
指示剂的颜色变化与酸度有关:
[In-] [H+]
KHIn = (离解常数)
[HIn]
[HIn]
[H+] = KHIn·
[In]
[HIn]
pH = pKHIn - log
[In-]
由此可见:溶液的pH值即酸度是由{[HIn]/[In-]}决定,也即指示剂颜色的变化也是由{[HIn]/[In-]}决定。
根据人眼对颜色的敏感度:
lilongfei14
第6楼2011/11/18
当[HIn]/ [In-]≥10 ,即pH ≤ pKHIn - 1 时,只能看到酸式色[HIn];
当[HIn]/[In-]≤1/10,即pH ≥pKHIn + 1 时,只能看到碱式色[In-];
当10≥[HIn]/[In-]≥1/10 时,看到的是它们混合颜色。
指示剂的变色范围:将人们的视觉能明显看出指示剂由一种颜色转变成另一种颜色的PH范围。
pH = pKHIn ± 1
当[HIn] = [In]时,pH = pKHIn
此时的pH称为理论变色点,又称指示剂滴定指数pT。
实际工作中指示剂的变色范围和理论计算是有出入的,例如甲基橙指示剂pKa=3.4,理论计算其变色范围为:pH = pKa±1=3.4±1 = 2.4~4.4,但实测结果为:3.4~ 4.4。甲基橙指示剂变色点:pT = 4(实测)
2、混合指示剂
混合指示剂:颜色变化明显,变色范围较窄的指示剂。
分类:(1)指示剂 + 惰性染料。
(2)2种或以上指示剂混合。
例如:甲基红和溴甲酚绿混合制剂。
甲基红 pH<4.4 pKHIn=5.0 pH>6.2
红色 黄色
溴甲酚绿 pH<4 pKHIn=4.9 pH>5.6
黄色 蓝色
一份0.2%甲基红 + 3份0.1%溴甲酚绿
pH<4.0~4.4 pKHIn=5.4 pH>5.6~6.2