MSI1在人小细胞肺癌细胞系中的表达及MSI1低表达
细胞模型的构建
实验方法与步骤
细胞的复苏
1.复苏前的准备:打开水浴锅,设置温度37℃;紫外线将超净台消毒30 min;配置完全培养基。
2.将要复苏的H69、H446细胞从液氮取出,用一次性PE手套包裹冻存管,迅速放入水浴锅中震荡,使其快速融化。
3.在15 mL离心管中加入5 mL完全培养基及融化的细胞悬液,900 r/min离心8分钟,弃去上清,得到细胞沉淀。
4.在25 cm2的培养瓶中加入5 mL完全培养基,并用1 mL培养基将沉淀的细胞重悬并加入准备好的培养瓶中,放入CO2恒温培养箱中继续培养。
细胞的传代
1.选取在悬浮培养瓶中生长至90%的H69细胞,用移液枪将细胞悬液移入15 mL离心管中,选取在贴壁培养瓶中生长至90%的H446细胞,用PBS溶液将细胞吹至漂浮,并移入15 mL离心管中,两种细胞均900 r/min离心8分钟,弃掉上清。
2.分别在3个25 cm2培养瓶中加入5 mL完全培养基,在细胞沉淀中加入3 mL培养基并充分吹打混匀,将3 mL细胞悬液平均放入3个培养瓶中并混匀,放入培养箱中继续培养。
MSI1低表达细胞模型的构建
1.从-80℃冰箱取出慢病毒载体冰上融化,将慢病毒用空白培养基稀释为滴度2×108,充分混匀,准备好病毒感染增强液。
2.将25 cm2悬浮培养瓶中H69细胞移入15 mL离心管中并用移液枪充分吹打混匀,取其中500 μL放入细胞计数仪中计数,取出1.2×106个细胞置入新的离心管中,加入空白培养基至6 mL。
3.在12孔板中以MOI=10的病毒滴度进行感染,培养16 h。
4.16 h后将细胞悬液离心,换成不加双抗的完全培养基继续培养,72 h后观察荧光。
5.待细胞生长至状态良好,加入1 μg/mL嘌呤霉素筛选至90%以上细胞均产生荧光。
荧光实时定量PCR(Q-PCR)检测MSI1在mRNA水平的表达
总RNA的提取
分别将细胞离心,PBS缓冲液清洗2次,900 r/min离心8 min,得到细胞沉淀。分别加入1 mL Trizol,用移液枪吸打至细胞完全破裂,加入200 μL氯仿,震荡30 s,室温静置10 min,以有效分离无机相和有机相,随后4℃,12,000 g/min离心15 min。将上清移至高压过的1.5 mL离心管中,加入与上清等体积的异丙醇,轻柔颠倒震荡数次,室温静置10 min,随后4℃,12,000 g/min离心10 min。弃去上清,加入75%无水乙醇,4℃,12,000 g/min离心5 min。弃去上清,沉淀置于冰上自然干燥,但不可完全干燥。用30 μL DEPC水溶解总RNA。用NanoDrop One超微量分光光度计进行定量和纯度检测,用1%琼脂糖凝胶电泳进行完整性检测。
cDNA的合成
逆转录体系
试剂名称
|
使用量
|
模板RNA
MonScriptTM 5*RT111 All-in-One Mix
MonScriptTM dsDNase
Nuclease-Free Water
| 1 μg 4 μL 1 μL up to 20 μL |
将混合液轻柔吹打混匀,瞬时离心,37℃ 2 min,55℃ 15 min,85℃ 5 min,得到cDNA。
Q-PCR检测MSI1 mRNA的表达
GAPDH引物序列:
Forward primer:
Reverse primer:
|
5’-GGTCGGAGTCAACGGATTTG-3’
5’-ATGAGCCCCAGCCTTCTCCAT-3’
|
MSI1引物序列:
Forward primer:
Reverse primer:
|
5’-GAACCATCCCGTCCTGTATCA-3’
5’-GAAACCATGAAGCCCCAACC-3’
|
Q- PCR反应体系:
Q-PCR反应体系
试剂名称
|
使用量
|
cDNA
Forward primer
Reverse primer
MonAmpTM Chemhs qPCR Mix
Low ROX
Nuclease-Free Water
| 50 ng 0.2 μL 0.2 μL 5 μL 0.1μL up to 10 μL |
Q-PCR反应程序:
Q-PCR反应程序
反应步骤
|
反应温度
|
反应时间
|
循环次数
|
预变性 | 95℃ | 10 min |
1
|
变性 | 95℃ | 10 s |
40
|
退火 | 55-65℃ | 10 s |
延伸 | 72℃ | 30 s |
溶解曲线
|
溶解曲线按仪器默认溶解曲线
|
结果采用t检验,用Graphpad prism5计算MSI1在mRNA水平的表达量。
Western blot检测MSI1在蛋白水平的表达
总蛋白的提取
将对数生长期的H69-NC、H69-shMSI1细胞移入15 mL离心管中,900 r/min离心8 min,并用PBS溶液洗涤2次,以去除培养基中血清影响。分别加入含PMSF的蛋白裂解液100 μL,与细胞充分混匀。4℃裂解1小时后,4℃,12000 g/min离心15 min,将上清移至新的离心管中,得到细胞总蛋白。
BCA法测定蛋白浓度
将Solution A和Solution B以50:1的体积比配置BCA工作液,充分混匀。将2 mg/mL蛋白标准品等比稀释,最小浓度为125 μg/mL,并分别与配置好的200 μL BCA工作液混匀,铺入96孔板中。37℃孵育30 min,测定波长562 nm处OD(光密度值)值,并绘制蛋白标准曲线。
取适量H69-NC、H69-shMSI1细胞总蛋白,20:1稀释后,与200 μL BCA工作液混合均匀。37℃孵育30 min,用酶标仪测定波长562 nm处OD值,根据标准曲线计算出样品中的蛋白浓度。
Western blot检测MSI1蛋白的表达
分别收集对数生长期的H69-NC、H69-shMSI1细胞总蛋白,加入相应体积4×SDS Loading Buffer,沸水浴煮5 min,分别取40 μg细胞总蛋白,在提前配制的10% SDS-PAGE分离胶电泳。电泳结束后,将蛋白转至PVDF膜上。用含5%脱脂牛奶的封闭液 37℃封闭1.5 h。弃去封闭液,用TBST缓冲液洗3次,每次10 min,加入MSI1兔单克隆抗体(1:1000),并以GAPDH为内参,加入GAPDH鼠单克隆抗体(1:5000);4℃孵育过夜,次日用TBST缓冲液洗膜3次,每次10 min。在敷有MSI1抗体的膜上加入辣根酶标记山羊抗兔IgG(1:5000),在敷有GAPDH抗体的膜上加入辣根酶标记山羊抗鼠IgG(1:5000),37℃敷育1 h,TBST 缓冲液洗膜3次,每次10 min。用增敏化学发光底物试剂检测,暗室曝光显影。在GAPDH表达量相同的情况下比较MSI1的表达情况。多次重复,应用ImageJ计算出各个蛋白条带的灰度对比,结果采用t检验,并应用Graphpad prism5作出柱状图。
MSI1在人小细胞肺癌细胞系中高表达
提取人正常肺上皮细胞BEAS-2B、小细胞肺癌细胞H446、H69的RNA,利用Q-PCR检测MSI1在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图2-1显示,MSI1在小细胞肺癌细胞系H446、H69中的表达远远高于正常肺上皮细胞。
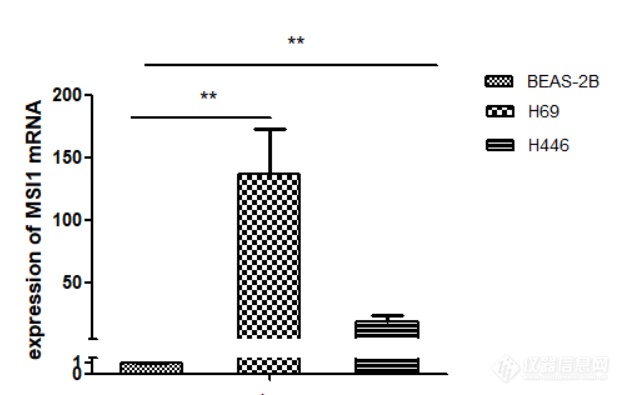
1 MSI1 mRNA在小细胞肺癌细胞系中的表达(**代表与正常肺上皮细胞相比,小细胞肺癌细胞MSI1表达量增高具有统计学意义,P<0.01)。
MSI1低表达细胞模型的构建
本实验选取人小细胞肺癌细胞系H69细胞,使用慢病毒感染技术敲低MSI1的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选,然后在荧光显微镜下观察如图2-2,可见H69-NC、H69-shMSI1细胞均产生绿色荧光,表明人小细胞肺癌H69细胞慢病毒感染成功。
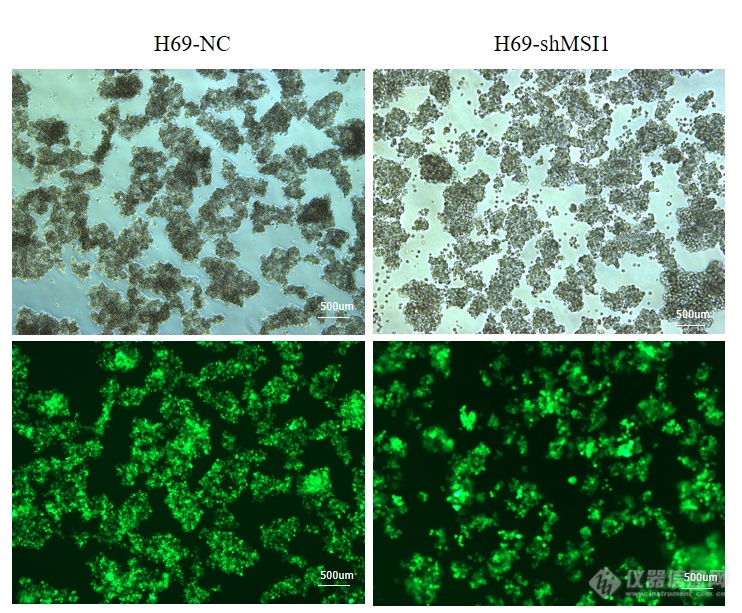
MSI1低表达细胞模型的构建。应用shMSI1慢病毒载体感染H69细胞,利用嘌呤霉素筛选,并在荧光显微镜下观察。
荧光实时定量PCR(Q-PCR)检测MSI1的mRNA表达水平
提取对数生长期的H69-NC、H69-shMSI1细胞的RNA,并测量RNA浓度及完整性,用1%琼脂糖凝胶电泳检测完整性可见,RNA有三条带,从上到下依次为28S rRNA、18S rRNA和5S rRNA,且28S rRNA的亮度是18S rRNA的两倍。用NanoDrop One超微量分光光度计测定人总RNA的A260/A280的值为2.00左右,A260/A230的值为2.30左右,说明提取的RNA质量和完整性很好,可以用于后续试验。利用Q-PCR技术检测各细胞内MSI1 mRNA相对表达量,结果如图2-3所示,与对照组相比,H69-shMSI1组MSI1 mRNA表达量明显降低(P<0.01),抑制率约为75%。
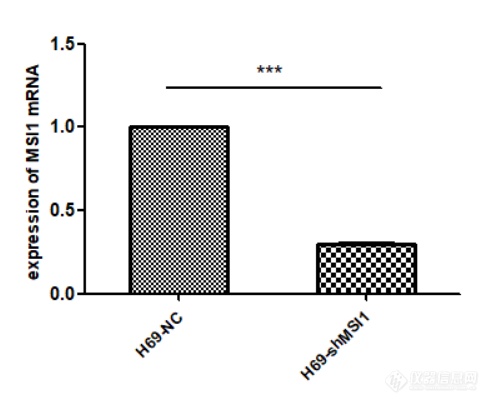
MSI1在RNA水平的表达(***代表与对照组相比,H69-shMSI1组MSI1 mRNA表达量下降具有统计学意义,P<0.001)。
Western blot检测MSI1蛋白表达水平
将BSA标准品(2 mg/mL)进行等比稀释,最低浓度为125 ug/mL,并应用BCA蛋白质浓度测定试剂盒测定在波长562 nm下的OD值,以OD值为纵坐标,对应蛋白质浓度(μg/mL)为横坐标,绘制标准蛋白曲线如图2-4所示。

图2-4 标准蛋白曲线
分别提取H69-NC、H69-shMSI1细胞的总蛋白质,利用Western blot技术检测各细胞内MSI1蛋白的表达情况。结果如图2-5所示,与对照组相比,MSI1蛋白表达在H69-shMSI1细胞中明显降低。表明MSI1低表达细胞模型构建成功。
a
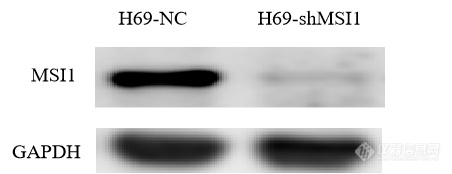
| b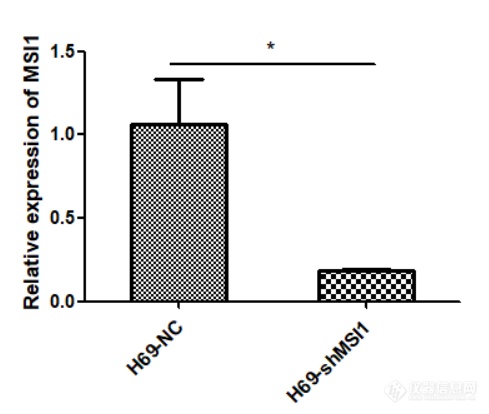 |
图2-5 MSI1蛋白水平表达:(a)MSI1蛋白表达条带;(b)MSI1蛋白的相对表达量。(*表示与对照组相比,H69-shMSI1组MSI1蛋白表达下降具有统计学意义,P<0.05)。
首先验证MSI1在小细胞肺癌细胞系中的表达情况,利用Q-PCR技术检测在RNA水平,MSI1在肺正常上皮细胞及小细胞肺癌细胞系中的表达,结果显示,MSI1在小细胞肺癌细胞中的表达明显高于正常肺上皮细胞。随后以人经典型小细胞肺癌细胞系H69细胞为研究对象,构建MSI1低表达细胞模型,应用shMSI1慢病毒载体感染H69亲本细胞,同时设置对照组除外病毒本身对细胞产生的影响,利用Q-PCR及Western blot验证MSI1在RNA及蛋白水平的表达,结果显示,H69-shMSI1组MSI1的mRNA及蛋白的表达明显降低。表明MSI1低表达细胞模型构建成功,可以用于后续实验。





