快速过柱除杂-超高效液相色谱串联质谱法测定油条中丙烯酰胺的优化研究
王书舟
(安阳市疾病预防控制中心,河南 安阳455000)
摘要:目的 优化改进快速过柱除杂-超高效液相色谱串联质谱(UPLC-MS/MS)准确测定油条中丙烯酰胺含量的方法。方法 样品加入丙烯酰胺-13C3同位素内标,经提取、除脂、盐析后,直接过SCX柱快速除杂,氮气吹干后纯水复溶后测定,对比不同体积正己烷除脂效果,以及C18和HSS T3色谱柱分离测定结果,优化梯度洗脱和质谱条件。结果 油条中丙烯酰胺测定需要较大体积的正己烷除脂,采用HSS T3色谱柱更有利于丙烯酰胺测定,在优化后的色谱质谱条件下丙烯酰胺在5.0~500.0 ng/mL范围内线性关系良好,相关系数r≥0.999 0,方法检出限2.0 μg/kg,加标10.0μg/kg-100.0μg/kg,回收率在97.6%~105.7%之间,RSD为2.2%~3.9%,标准物质测定结果符合要求。结论 该方法经正己烷除脂和SCX柱除杂净化后,有效降低油条样品基质对测定带来的影响,操作简捷,准确度好,可用于油条中丙烯酰胺的准确测定。
关键词:丙烯酰胺 油条 超高效液相色谱串联质谱
Fast column removal of impurities -Optimization of determination of acrylamide in fried dough sticks by ultra performance liquid chromatography tandem mass spectrometry
Wang Shuzhou1,
(Anyang Center for Disease Control and Prevention,Henan Anyang 455000,China)
Abstract:Objective Optimization and improvement of the method for the accurate determination of acrylamide in oil strips by using UPLC MS / MS.Methods Acrylamide-13C3 isotope internal standard was added to the sample. After extraction, degreasing and salting out, the impurities were quickly removed by SCX column. After drying with nitrogen, the samples were dissolved in pure water and determined. The degreasing effect of different volumes of n-hexane and the separation and determination results of C18 and HSS T3 columns were compared. The gradient elution and mass spectrometry conditions were optimized. Result The determination of acrylamide in oil strip requires a large volume of n-hexane to remove grease. It is more convenient to use HSS T3 column to determine acrylamide,Under the optimized conditions,the linear range of acrylamide was 5.0-500.0 ng/mL, the correlation coefficient was r ≥ 0.999 0, the detection limit was 2.0 μ g / kg,spiked 10.0 μ g / kg-100.0 μ g / kg, the recovery was 97.6% - 105.7%, RSD was 2.2% - 3.9%, and the results of standard materials met the requirements. Conclusion After n-hexane degreasing and SCX column purification, the method can effectively reduce the influence of the sample matrix on the determination of acrylamide in fried dough sticks. The operation is simple and the accuracy is good. It can be used for the accurate determination of acrylamide in fried dough sticks.
Key words: Acrylamide, Deep-Fried Dough Sticks ,UPLC-MS/MS
油条是一种古老的中式面食,是中国传统的早点,也是我国居民食用最广泛的面食之一,流通范围广,食用频率高[1-2]。2002年瑞典科学家在高温处理富含碳水化合物的食物中检测出高浓度的丙烯酰胺以来,食品中丙烯酰胺污染便成为广受关注的食品安全问题[3-6]。这些食品包括油炸和焙烤马铃薯制品 (薯条和薯片)、烤咖啡、面包和饼干等高温加工食品[7-8],一般公认的形成机制是食物中氨基酸(主要是天冬酰胺)和还原糖在高温下发生Mailllarder反应生成AA[7-10], AA对人类具有神经毒性、遗传毒性、肝脏毒性等,并已被国际癌症研究机构( IARC) 列为二类致癌物[3,11-12],动物实验证实其还具有生殖毒性[6]。
目前国内外检测食品中丙烯酰胺的方法较多[13],食品安全国家标准GB 5009. 204 - 2014中提供第一法稳定性同位素稀释的液相色谱-质谱/质谱法(LC-MS/MS)和第二法稳定性同位素稀释的气相色谱-质谱法(GC-MS)[14],以及在这两种方法基础上改进前处理的一些方法[6,15],但LC-MS/MS法前处理采用基质固相分散萃取法和固相萃取柱净化法两种,均需要较为繁琐的淋洗、洗脱、浓缩,GC-MS法需要衍生处理,过程复杂,影响重复性,并且两种方法以及改进的一些方法适用范围多为热加工(煎、炙烤、烘焙)食品,对油条这种含油量大的油炸食品并不完全适用。本方法针对高含油量的油条基质,对前处理、仪器条件进行优化,建立了一种简单快捷灵敏,特异性强的油条中丙烯酰胺的LC-MS/MS测定方法,适用于高油食品大批量检测工作。
1 材料与方法
1.1 仪器与试剂 高效液相色谱串联质谱仪(美国waters TQ-S);电子天平(感量0.001 g赛多利斯BT-223S);料理机(九阳 JYL-B060);多位试管涡旋振荡器(德国Heidolph Multi Reax);漩涡混匀器(SCILOGEX MX-S); 氮吹仪(美国 organomation,N-EVAP-112);乙腈(CH3CN 美国默克公司 色谱纯);SCX固相萃取柱(Welchrom 60mg/3ml);丙烯酰胺标准溶液(北京坛墨 100.0 μg/mL)、丙烯酰胺-13C3内标溶液(TMstandard 1000.0 μg/mL),丙烯酰胺标准物质P99274(广州谱恩科学仪器有限公司,106±25μg/kg)。
1.2 标准溶液配置
取100.0 μg/mL丙烯酰胺标准溶液,用水稀释,配成浓度为 1.0 μg/mL 的标准使用液; 取1000.0 μg/mL丙烯酰胺-13C3内标溶液,用水稀释,配制浓度为 5.0μg/mL 的内标使用液。
分别准确吸取丙烯酰胺标准使用液5μL、10μL、20μL、50μL、100μL、200μL、500μL于7个1 mL容量瓶中,再准确吸取丙烯酰胺-13C3使用液(5.0μg/mL)20μL于以上7个容量瓶中,加水定容。标准系列溶液中丙烯酰胺浓度分别为5.0、10.0、20.0、50.0、100.0、200.0、500.0ng/mL,含丙烯酰胺-13C3浓度为100 ng/mL。在1.3.2和1.3.3测定条件下,依次对标准空白,标准系列,样品空白及样品进行测定,以系列中AA含量为横坐标,以AA及其内标物的定量离子峰面积比值为纵坐标,得到内标法标准曲线及回归方程,根据样品响应计算AA含量。
1.3 方法
1.3.1 样品提取及净化 准确称取油条样品2 g(精确至0.001 g),于50 mL离心管中,加入丙烯酰胺-13C3使用液(5.0μg/mL)20μL,加入8 mL水后涡旋,加入10 mL乙腈,8mL正己烷,涡旋3min。静置1min,加入2.0 g 无水醋酸钠和6.0 g无水硫酸镁,振荡涡旋40 min。冷冻离心机4℃、8000 r/min离心5 min,弃去上层的正己烷层,取中间乙腈层3mL过SCX 小柱,收集乙腈溶液,在氮气下吹干,用0.5mL水溶解残渣,过尼龙膜后测定。
空白试验:除不称取样品外,处理步骤同样品。
1.3.2 液相色谱条件 色谱柱:AcquityUPLC®HSS T3柱(2.1×100 mm,1.8 μm);柱温:35 ℃;样品室温度:15 ℃;进样量:10 μL,流动相:A:0.1%甲酸水溶液;B:甲醇。流速:0.3 mL/min;采用梯度洗脱:0~3.5min,90%A~10%A;3.5~4.5min,10%A;4.5~5.5min,10%A~90%A;5.5~6.5min,90%A。
1.3.3 质谱参考条件 电离源:电喷雾离子源,ESI+;毛细管电压:3.0KV;离子源温度:150 ℃。脱溶剂气温度:500 ℃;脱溶剂气流量:800L/H;锥孔反吹气流量:150L/H;检测方式:多离子反应监测MRM。目标物质谱参数见表1。
表1 目标物的主要质谱参数
 注:*为定量离子
注:*为定量离子
2 结果与讨论
2.1前处理条件的优化
油条样品主要成分为淀粉,辅助有盐、 碱、 矾等物质[1],干扰来源主要是油脂和无机盐类,丙烯酰胺易溶于水、乙腈等溶剂,在水中溶解性较强,但如果用水提取,会引入有大量水溶性杂质,选用乙腈和水分散提取,盐析后可以有效降低无机盐类的影响,同时油条含油量较高,对比不同体积正己烷(3、5、8、10、12mL)除脂效果,发现加入8mL正己烷分层明显,有利于吸取,正己烷加入量小于5mL,有较大的基质效应,且存在过柱净化堵塞现象,正己烷大于8mL,基质效应不再有明显改善,故选择8mL正己烷作为最佳除脂体积。提取液除脂后直接过SCX柱除杂,SCX小柱同时具有反向保留和强阳离子保留模式,对提取液中强碱性阳离子状态的杂质保留,对丙烯酰胺不保留,达到除杂目的,省去活化、淋洗、洗脱等步骤,操作简单。
2.2 基质效应
基质效应一般采用空白样品溶液加标与纯溶剂标准溶液来比较评价[16],本文采用低浓度样品(扣除本底值响应)代替空白样品,将净化前和净化后的提取液分别氮吹后纯水复溶得到两种基质溶液,配制加标样品,测定其响应(A)与纯水配制的相同浓度的标准响应(B)比较,利用公式[17]计算基质效应(ME) ,(n=3),结果显示两种基质均存在基质抑制作用,净化前基质效应约为-87.4~-75.6%, 净化后基质效应约为-31.9~-22.3%, 净化后基质抑制作用明显降低。
,(n=3),结果显示两种基质均存在基质抑制作用,净化前基质效应约为-87.4~-75.6%, 净化后基质效应约为-31.9~-22.3%, 净化后基质抑制作用明显降低。
2.3同位素内标的选择
内标法是通过测定内标物和待测组分响应的相对值来进行计算的,一定程度上能消除提取效率、过柱损失、基质效应等方面的误差,内标选择的原则之一是内标物应为试样中不存在的纯物质,对丙烯酰胺标准测定发现其在检测通道73.1/55.9(丙烯酰胺-13C1)和74.1/56.9(丙烯酰胺-13C2)也有较为明显响应见图1,响应值为标准响应的1/25和1/200,而在75.1/57.9(丙烯酰胺-13C3)无明显响应,即如果选择丙烯酰胺-13C1和丙烯酰胺-13C2作为内标,样品中的丙烯酰胺会对内标响应有贡献,干扰测定,对丙烯酰胺-13C3测定发现其对丙烯酰胺的定性定量离子通道均无干扰,故应选择丙烯酰胺-13C3作为内标物。
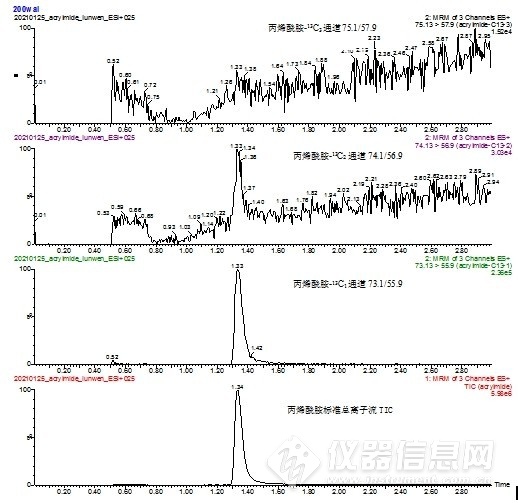
图1 丙烯酰胺标准在内标检测通道的响应
2.4 色谱柱选择
丙烯酰胺极性较强,在普通C18色谱柱保留不强,出峰时间较早,不利于与样品中极性物质的分离,HSS T3柱采用低配基密度C18和三点键合技术,能够耐受100%水相,增强了水溶性的、极性大的小分子有机化合物的保留,延长了丙烯酰胺的保留时间,有利于与共流出物的分离,同时峰型和响应也得到改善,见图2
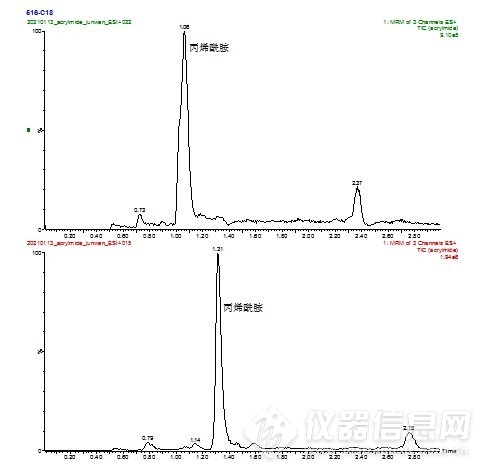
注:上:C18柱,下 HSS T3柱
图2 普通C18柱和 HSS T3柱样品测定总离子流对比
2.5 质谱条件优化 配置100 ng/mL的丙烯酰胺标准溶液及其内标溶液,使用仪器智能方法开发程序,确定碰撞气能量、碰撞池电压等质谱参数,保存为该化合物最佳响应条件。其中丙烯酰胺响应较好的子离子分别有54.9,43.9,27.15,对于本实验54.9作为定量离子,43.9虽然绝对响应较27.15高,在标准测定中响应和干扰均较为理想,见图3,但对实际油条样品的测定发现,通道内干扰较大,见图4,即子离子43.9不适合作为油条样品的定性离子,故选择干扰较小的27.15作为定性离子。
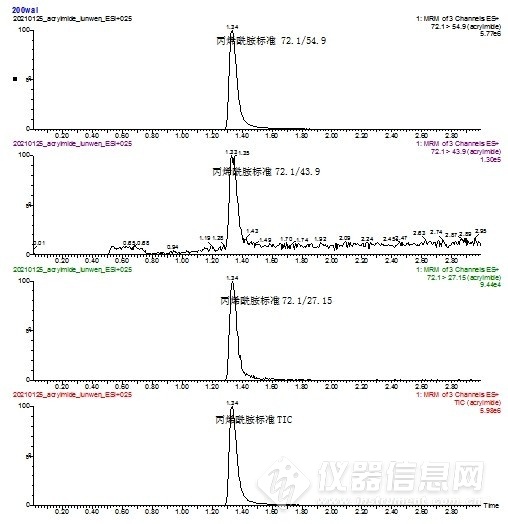
图3 标准中总离子流及子离子图谱
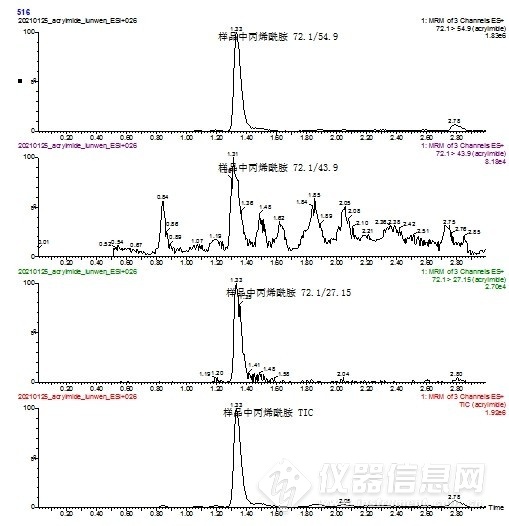
图4 油条样品测定总离子流及子离子图谱
2.6 线性范围和检出限 在本仪器条件下对标准工作液进行测定,丙烯酰胺在5~500 ng/mL浓度范围内,呈现良好线性关系,线性方程为Y=0.076x+0.00544,相关系数r为0.9995。准确称取2g低值(8.8μg/kg)样品,按本法进行前处理,测定6次,平均信噪比S/N为15.7,基于丙烯酰胺普遍检出,空白试验均未检出,确定本方法定量限为6.0μg/kg(S/N=10),检出限为2.0μg/kg(S/N=3)。
2.7 准确度和精密度 通过对底浓度样品进行加标测定回收率来检验准确度及精密度。取2.0g样品分别加入20 μL,50 μL,200 μL标准储备溶液(1.0 μg/mL),静置后混匀得到10.0、25.0、100 .0μg/kg 3个水平加标样品,经预处理后,每个浓度平行测定6份,计算回收率和精密度,回收率在97.6%~105.7%之间,RSD为2.2%~3.9%。测定结果见表2。
对丙烯酰胺标准物质P99274(106±25μg/kg)进行测定,测定结果为101.7 μg/kg(n=3)测定结果在标准物质含量范围内。
表2 加标试验回收率和精密度结果

2.8 方法应用 以本方法对90份样品进行测定,丙烯酰胺全部检出,含量范围4.8~157.0μg/kg,平均值±标准差(`x±s)为49.9±34.4,P50=43.6,目前我国在丙烯酰胺限量标准上并未做出限定,参考欧盟对食品中丙烯酰胺的基准值,按谷物类早餐300μg/ kg,所有样品均未超过基准值,但以全国居民每日油条消费量较大[2]的特点来看,应结合居民油条每日摄入量综合评估油条中丙烯酰胺限值。
3 结论
本文所优化建立的同位素内标-UPLC-MS/MS法测定油条中丙烯酰胺的方法,经最佳体积的正己烷除脂,SCX柱直接净化,不仅有效降低基质效应的影响,而且简化了操作步骤,有较好的精密度和回收率,使用HSS T3柱与极性较强的丙烯酰胺更为匹配,增强了AA的保留,使AA与共流出物分离更理想,线性范围宽,优选的目标物离子对,更为适合油条样品基质情况,较国标法有更低的检出限和定量限,为油条中丙烯酰胺的监测工作提供了便捷精确的测定方案,通过实际样品的测定,能够为油条中丙烯酰胺限值评估提供数据,为人群油条中丙烯酰胺膳食暴露风险评估工作提供支持。
参考文献
[1]谷利军,王凤成,邬大江. 油条的原料和配方综述[J]. 农业机械,2012,21:76-79.
[2]宇盛好,向宇,彭少杰. 上海市市售油条铝含量的风险监测及暴露评估[J]. 上海预防医学,2018,06:450-453.
[3]肖晓光,孙经淞,李双月,等.丙烯酰胺通过内质网应激诱导运动神经元VSC4.1细胞凋亡的研究[J]. 环境与职业医学,2017,12:1087-1092.
[4]吴诗华,曾文锋,郭冠浩, 等. 丙烯酰胺暴露来源及污染现况[J]. 职业卫生与应急救援,2019,06:605-608.
[5]徐进川,邝国鹏,杨继承, 等. 减少薯片中丙烯酰胺含量的方法探究[J]. 现代预防医学,2019,21:3886-3891.
[6]赵连佳,余焕玲,曹冬, 等. 同位素稀释超高效液相色谱-串联质谱法测定中式炒菜中丙烯酰胺的含量[J]. 现代预防医学,2019,03:506-510+526.
[7]王敏,杨雅利,沈海亮, 等.油炸马铃薯中丙烯酰胺形成的影响因素及控制措施的研究进展[J]. 农产品加工,2019,01:66-71.
[8]Recio L,Friedman M,Marroni D,et al. Impact of acrylamide on Calcium signaling and cytoskeletal filaments in testes from F344 rat[J].International Journal of Toxicology,2017,36( 2) : 124 - 132.
[9]李振球,朱国军,苏子行, 等.高效液相色谱测定燃香中丙烯酰胺的研究[J]. 中国检验检测,2018,06:13-15.
[10]罗进斌,王祚懿,陈强, 等. 两起小作坊丙烯酰胺中毒事故的报告[J]. 环境与职业医学,2020,05:520-522.
[11]郝瑞芳,于蓉,张先平, 等.食品添加剂抑制丙烯酰胺形成和毒性的研究进展[J]. 农产品加工,2017,23:52-55.
[12]Katen AL,Chambers CG,Nixon B,et al. Chronic acrylamide exposure in male mice results in elevated DNA damage in the germline and heritable induction of CYP2E1 in the testes[J].Biology of Reproduction,2016,95(4) : 1-15.
[13]李莎,吴民富,蔡津津, 等.食品中丙烯酰胺检测研究进展[J]. 食品安全导刊,2019,18:175-177.
[14]中华人民共和国国家卫生和计划生育委员会.GB 5009.204-2014 食品安全国家标准 食品中丙烯酰胺的测定[S].北京:中国标准出版社,2015.
[15]陈子亮,闻胜,李永刚, 等. QuEChERS-超高效液相色谱-串联质谱法快速测定油炸食品中的丙烯酰胺[J]. 中国卫生检验杂志,2015,13:2107-2109.
[16]陈丹丹,简龙海,茹歌,俞灵,王柯,郑荣.QuEChERS-超高效液相色谱-串联质谱法测定食品中5种罂粟壳生物碱基质效应[J].中国食品卫生杂志,2019,31(02):111-115.
[17]沈斐,许燕娟,姜晟,赵斌,石浚哲,陈静.超高效液相色谱-串联质谱法测定水华样品中微囊藻毒素及其基质效应的消除[J].色谱,2017,35(07):772-777.


 注:*为定量离子
注:*为定量离子 ,(n=3),结果显示两种基质均存在基质抑制作用,净化前基质效应约为-87.4~-75.6%, 净化后基质效应约为-31.9~-22.3%, 净化后基质抑制作用明显降低。
,(n=3),结果显示两种基质均存在基质抑制作用,净化前基质效应约为-87.4~-75.6%, 净化后基质效应约为-31.9~-22.3%, 净化后基质抑制作用明显降低。



