获得一张完美超薄切片的“八要素”
吴佳楠,魏 潜
(中国农业科学院作物科学研究所,重大平台中心,北京100081)
摘要:组织细胞经过取材、固定、清洗、脱水、渗透、包埋和聚合、切片、染色等一系列的技术流程被制备成超薄切片后才能在透射电子显微镜下观察其超微形态结构。由于前期制样的环节多且复杂,每一个环节出现一些微小失误,经过叠加都会被放大,在进行超微结构观察时就会出现褶皱、空洞、裂纹、污染等“人工假象”。要去除这些“人工假象”,就需要在每个环节按照规定的要求仔细的操作,并时刻观察样品的状态,挑选符合要求的样品进入下一环节。这八个环节规定的要求包含着制备组织细胞超薄切片的关键点,也是获得完美电镜照片的关键点,这些关键点可以统称为“八要素”。
关键词:透射电子显微镜;细胞结构;制样;切片;污染;
中图分类号:Q-336;Q246;Q942.4
The "eight Elements" to get a perfect picture of ultrastructure
WU Jianan ,WEI QIAN
(Major Platform Center, Institute of Crop Sciences, Chinese Academy of Agricultural Sciences,Beijing 100081, China )
Abstract:Tissue cells were prepared into ultrathin sections by sampling, fixation, cleaning, dehydration, infiltration, embedding as well as polymerization, slicing, staining and other technical processes before ultrathin sections could be observed under transmission electron microscope. Due to the number and complexity of the processes of sample preparation in early stages, small mistakes in each process will be magnified after superposition, which may lead to "artificial illusion" such as folds, voids, cracks and pollution during observation. To remove these "artificial illusion", it is necessary to operate carefully in accordance with the requirements of each process, and observe the status of samples at all times, and select samples that meet the requirements to enter the next process. The requirements specified in these eight steps are the key points for preparing ultrathin sections of tissue cells and obtaining perfect electron microscope pictures. These key points can be collectively referred to as the "eight elements".
Keywords:Transmission electron microscope; Cell structure; Sample preparation. Slice; Pollution;
超薄切片是透射电子显微镜观察生物体组织细胞超微结构的主要载体。超薄切片的制备需要经过一系列的技术操作,包括组织目标位置的取材固定、清洗、脱水、渗透、包埋和聚合、切片和染色等。超薄切片的质量影响着组织超微结构,这取决于每一个环节需要按照技术要求操作,而这些技术要求中涉及到一些关键点,这些关键点可以称为制备一张完美的超薄切片的八个关键要素,简称“八要素”。
1完美超薄切片的“八要素”
1.1取材要精准
取材是进行超薄切片制备的第一步,也是关键的一步。取材位置的准确与否,关系到超薄切片中是否包含需要观察的组织;在确定取材位置的前提下,样品块的大小在一定程度上影响着超薄切片的质量。所以在进行取材之前,需要查阅相关文献,确定实验目的,从整体把握所需观察的组织细胞位于植株的相对位置[1]。对于有特殊观察位置的组织要将观察位置限定在取材范围的中心部分,再向四周扩充部分组织,用以保护观察位置,防止取材时的人为损伤。由于固定液渗透速率的限制,样品块的大小要控制在1mm3以内,对于无法将组织的各个层面控制在1mm2以内,至少要保证有一组相对位置的组织面积为1mm2[2]。比如横截面较大的植物茎秆,保证茎秆的取样高度在1mm以内,根据横截面的大小进行2-4等分,最终得到高度为1mm的扇形茎秆组织,尽可能的保存相对较多的维管组织,便于在光镜定位时有可选择性。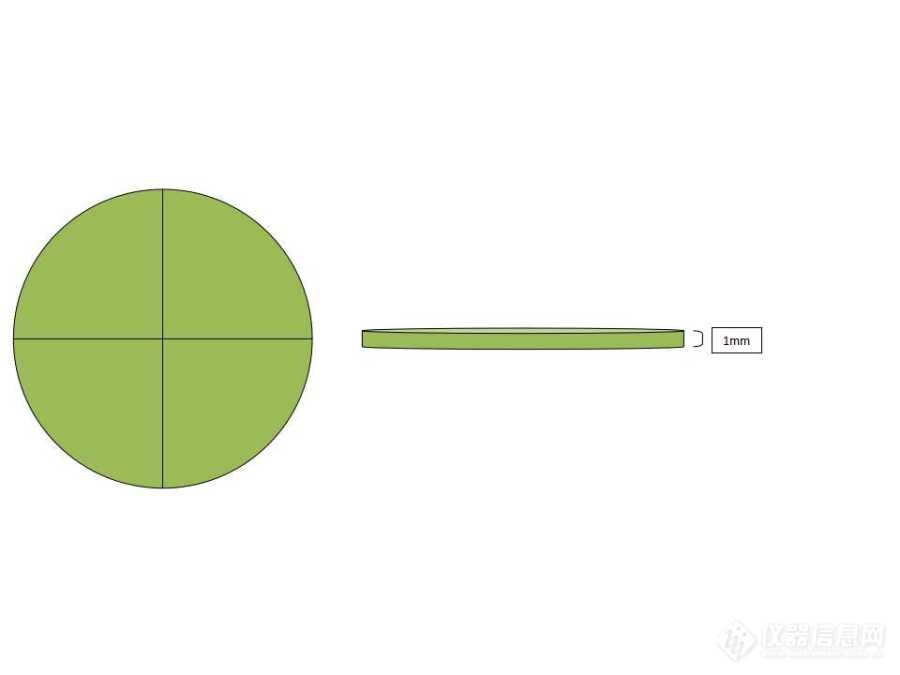
图1 茎秆取材方式
同一处理中的不同植株有不同的生长状态,在组织结构上也有明显的差异,不同植株在取材时产生的偏差会对实验结果带来不利的影响[2]。所以在进行取材时,对照组和处理组的取材要结合植株的具体生长状态决定,要做到具有相对参考性。为了提高结果的可靠性,需要在严格控制的条件下通过重复试验进行验证,包括同一处理不同植株和同一处理不同批次的重复试验[2]。
1.2 固定要及时
细胞是生物体进行生物化学作用的主要场所,富含大量的酶。当组织离开生物体后,其细胞会因为酶的作用发生降解,细胞内的各种细胞器也会随之发生变化。所以在取材的时候要尽快的进行固定,固定液可以与组织细胞内的蛋白质、脂质、糖原等生物大分子发生交联反应,在分子水平上保持细胞的生活状态,防止细胞超微结构的损伤[3]。同时,固定液与生物大分子产生稳定的交联结构,可以有效的防止细胞结构在清洗和脱水过程中的丢失。固定液的渗透存在一定的阻力,通过抽真空的方式加速固定液的渗透,同时也可以将植物组织中的空气抽出,获得良好的固定效果。对于不易固定或者长时间漂浮在固定液面上的组织,可以通过在固定液中滴加Trion X-100、Tween-20的方式提高固定效果。
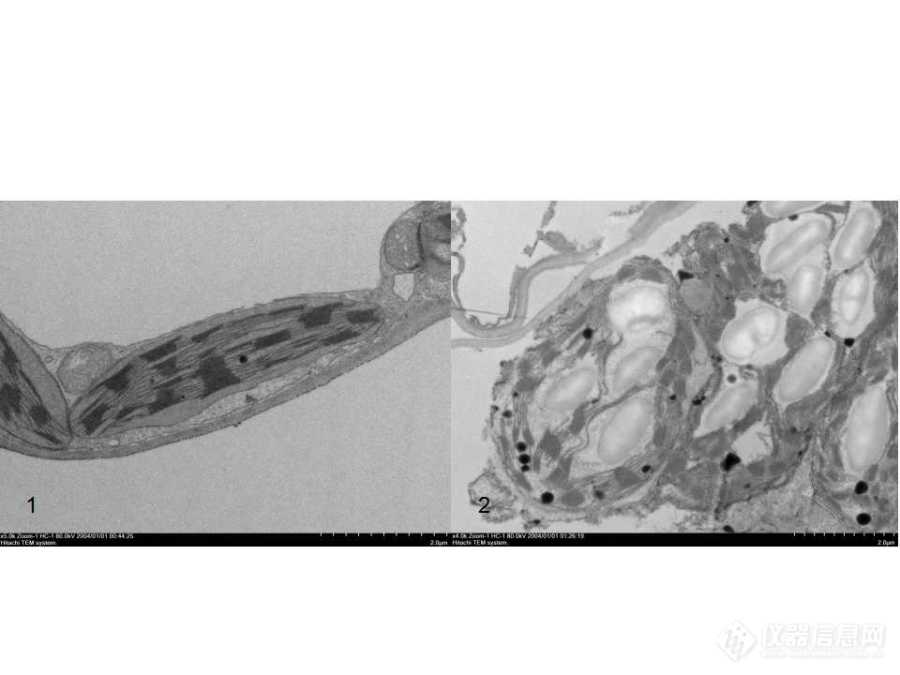
图2 固定良好与固定不良的叶绿体(bar:2um)
1:固定良好的叶绿体;2:固定不良的叶绿体
1.3清洗要彻底
组织细胞经过醛类固定液固定后,需使用相同的缓冲液充分漂洗,才能进行后固定。残留的醛类固定液会与后固定使用的四氧化锇反应产生沉淀;经四氧化锇后固定的组织细胞在脱水之前也需要使用形同的缓冲液充分清洗,洗去未参与反应的四氧化锇,这些残余的四氧化锇会被脱水使用的乙醇还原,产生不溶性的二氧化锇沉淀[2]。这些沉淀的形态,在电镜下可见为细小的颗粒状,主要积附在细胞结构的脂膜、基质等部位,是一种“人工假象”,影响组织细胞超微结构的观察。
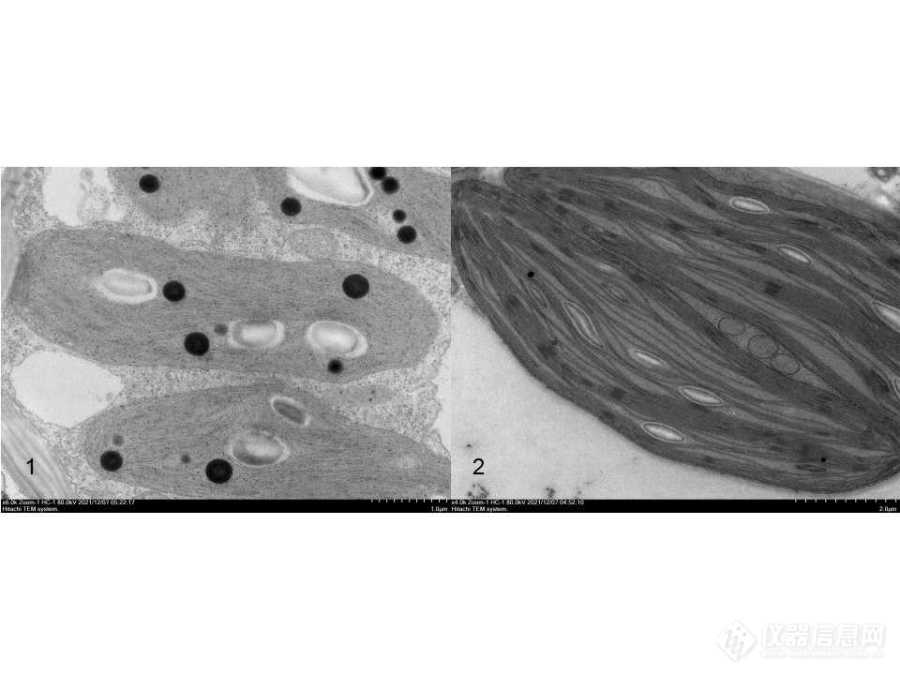
图3 清洗彻底与不彻底的叶绿体(bar:2um)
1:清洗不彻底造成的黑色颗粒污染“锇黑”;2:清洗干净无黑色颗粒污染
1.4脱水要充分
生物样品需要脱水的因素有以下几点:
①生物组织含水量较高,直接用于电镜观察会污染镜筒[2];
②电镜的真空环境会抽提组织中的水分造成细胞结构塌陷;
③渗透所需的树脂不溶于水,需要使用有机试剂将组织内外的水分置换[4]。
需要注意的是,不同的组织所需的脱水时间是不一样的。对于有细胞壁和液泡的植物组织,其脱水时间就要比动物组织相应的延长,以此来保证脱水的充分,因为残余的水分会造成细胞结构肿胀,出现空腔[2]。同时残留的水分也会影响树脂的渗透,导致局部结构破碎。因此,脱水时间要根据样品的特性进行适当调整。但是,过分的脱水会导致细胞结构丢失,这也是一种人为假象。
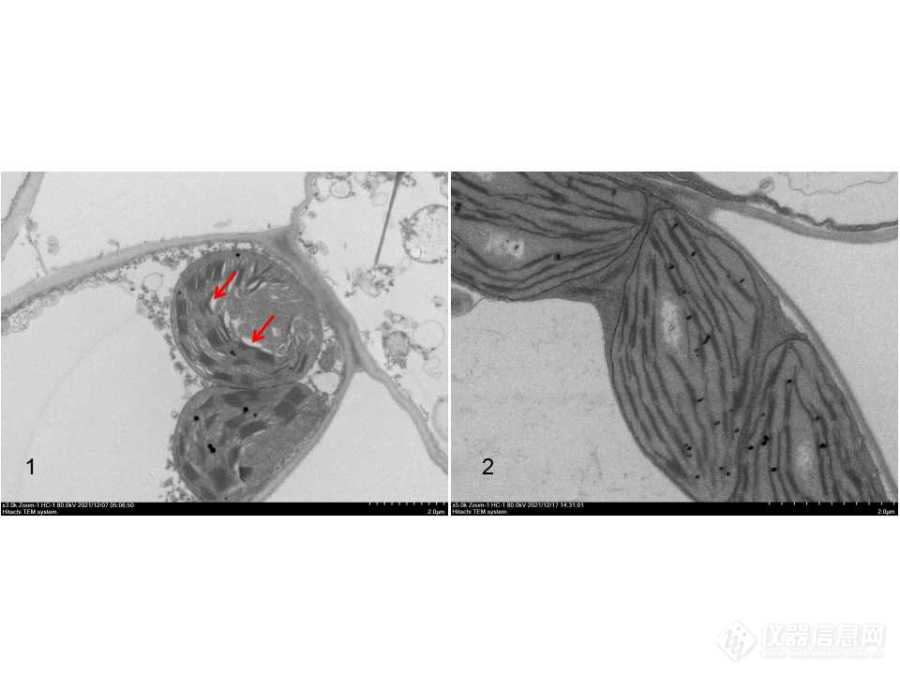
图4 脱水问题(bar:2um)
1:脱水不充分产生空腔(红色箭头指向部分);
2:脱水充分的叶绿体没有空腔
1.5渗透要均一
生物组织较为柔软,需要以树脂作为载体,为超薄切片提供应力支撑,同时也保证生物切片能够耐受电子束的轰击。植物组织细胞存在一些较难渗透的结构,如细胞壁、淀粉粒、脂质体等,渗透不良会造成这些结构与周围组织硬度不均一,在切片的时候产生褶皱、颤痕、裂纹[5],甚至部分组织细胞会在在切片的时候碎片化,影响超微结构的观察。
通过以下几个方面可以有效的增加渗透的效果:
①在树脂的选择方面,植物组织可以选择黏度低、渗透速率较快的Spurr树脂,配置比例参照坚硬配方;
②配置、保存树脂和渗透、包埋所需的容器最好提前一天在烘箱中72℃烘烤过夜,去除吸附在表面的水分;
③Spurr树脂配制需将四个组份按比例混合,使用磁力搅拌器充分搅拌均匀,保证每一滴树脂的成分均一;配制好的树脂若当天不使用,需放在4℃冰箱中低温保存,室温下树脂会缓慢聚合、黏度增加;
④树脂渗透采用抽真空的方式辅助进行,利用外力增加渗透效果,同时在真空皿中铺一层吸水硅胶,防止树脂渗透的时候吸潮;
⑤根据植物组织种类调整树脂渗透的时间和次数,对于坚硬或者致密的组织,树脂渗透的次数要增加,时间要延长;
⑥每次更换树脂的时候,要尽可能的吸走组织表面附带的多余树脂,可以采用将组织从待更换的树脂中挑出,放入新树脂中的方法,减少老旧树脂的残留。
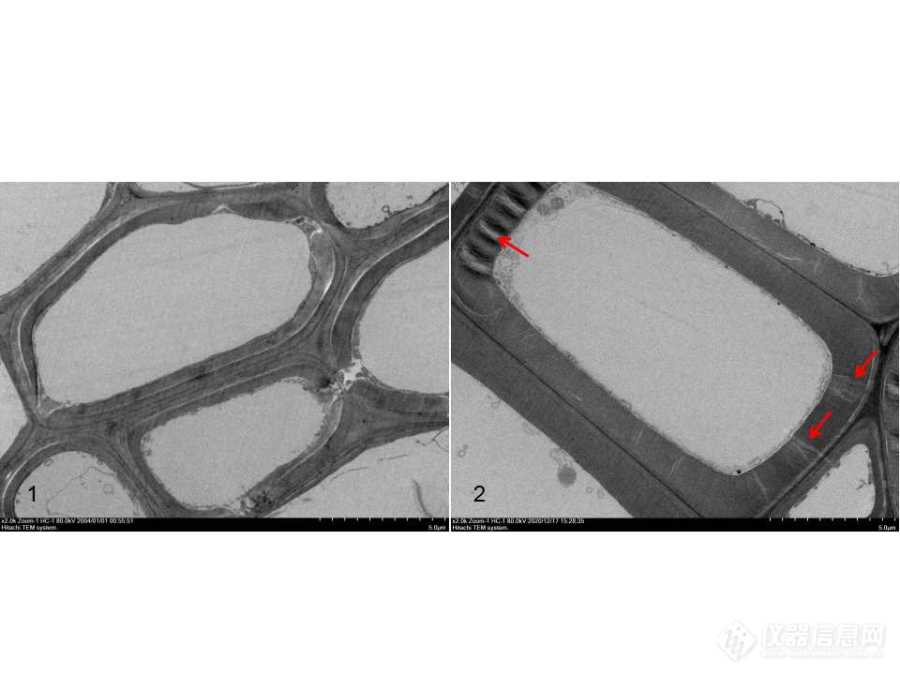
图5 渗透问题对比(bar:5um)
1:渗透均一的茎秆组织;2:渗透不均一的茎秆组织有裂纹(红色箭头指向部分)
1.6 包埋要定向
植物组织生长具有明显的方向性,要根据观察部位相对于组织整体的位置确定包埋的方向。在包埋聚合时,组织在包埋板中的位置会发生偏移,需要定时进行调整,一般在聚合开始前的4-6小时,树脂会呈现由粘稠到稀薄的变化过程,可以利用牙签深入树脂中调整组织位置;当超过6小时之后,树脂的粘稠度会直线上升,调整组织位置会受到较大的阻力,组织容易受损。对于方向偏移的组织,切片呈现的细胞形态及排列会发生变化,甚至形变,这对于观察细胞生长发育变化和组织半薄定位产生较大的影响。所以,在包埋的时候一定要控制好样本的方向性,防止它在聚合的过程中发生位置偏移。

图6 水稻根尖中柱细胞(红色方框标注部分)
1.7 切片要平整
切片是呈现细胞形态关键环节,厚度一致、平整连续的切片是一个组织前处理良好的标准之一。若在切片上出现刀痕、颤痕、褶皱、切片破损现象,可以在一定程度上反应组织的渗透、树脂块的硬度、切片刀、切片环境等问题。
①刀痕(异物损伤):刀痕是垂直于刀口并纵贯切片的划痕[6],会破坏细胞结构,一般是由于组织块中有硬质颗粒,损伤刀口后在切片上留下痕迹;或者组织块破碎掉下来的粉末,粘在刀口上,反过来损伤切片[7]。这些都是因为树脂渗透不良造成的,可以修掉硬质颗粒和破碎的组织、清洗掉粘在刀口上的颗粒后再切片。
②颤痕(震动损伤):颤痕是平行于刀口而横贯切片的、平行排列、切片厚度周期性变化的一组波纹。主要是因为树脂软硬程度不同(内部)和样品头松动、环境波动(外部)两种因素造成的。内部因素的产生在于树脂渗透不良、树脂配制时混合不均匀、树脂比例不合适、较软(spurr树脂可以增加736的比例)、聚合不彻底等,可以通过将树脂块进一步修整缩小切面、在烘箱中高温烘烤树脂块、增加刀角、降低切片速度等进行调整[7];对于外部因素,则需要考虑切片机的震动、切片环境的稳定程度(是否有风)、样品头的松紧、树脂块的长短等,逐项排除、确定问题、进行调整。
③褶皱(挤压损伤):褶皱有两种形态,一种是在切片中形成的,渗透不良、质地较软的组织,在切片时受到刀刃的挤压形成褶皱,电镜下观察为波纹状;另一种是在捞片过程中形成的,在于捞片时槽液的颤动和有膜载网亲水性不均一,使得切片贴合载网的过程中受到干扰,从而形成不规则的长线状褶皱[8]。增加渗透时间和次数、提高渗透效果、调整树脂的比例;使用捞片环捞片、增加载网的亲水性可以在一定程度上减少褶皱的形成。
④切片破损(缺失损伤):切片空洞和切片碎沫化都是切片破损。固定时真空不足、换液接触空气、树脂渗透不充分是形成切片空洞的主要因素[9],电镜下可见部分组织缺失,被圆形空腔取代且无树脂填充;脱水不充分、树脂吸潮或者渗透不充分则会导致切片呈现碎沫化,或者切片漂浮在水面上片刻后化开,主要在于组织中残留水分。解决上述问题的关键在于减少空气的干扰、防止水分渗入、保持环境干燥、脱水渗透要充分。
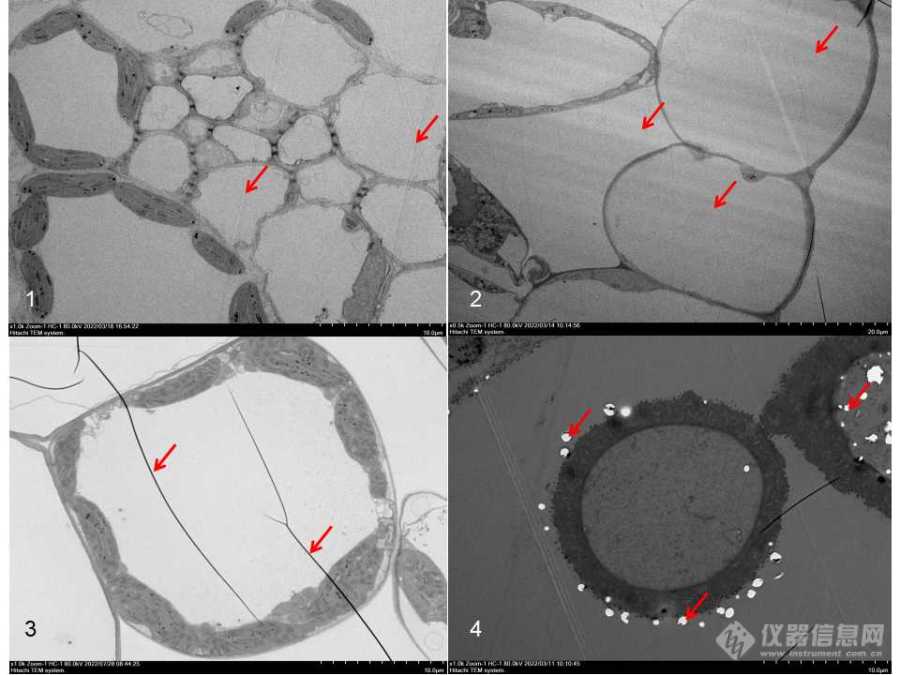
图7 切片问题(红色箭头指向部分)(bar:10um)
1:切片刀痕(异物损伤);2:颤痕(震动损伤);
3:褶皱(挤压损伤);4:空洞(缺失损伤)
1.8 染色要干净
生物组织的主要成分为C、H、O、N,对高能电子束的散射能力较弱,在电镜下成像的衬度较差[10],细胞结构信息不清晰。由于重金属染液对细胞结构有特异性的结合能力,经染色后的组织切片对电子束的散射能力因结合重金属的多少而不同,在电镜下呈现出结构清晰的电镜图片[11][12]。
然而,在实际的染色过程中,由于环境和pH的影响,染液成分会在切片上形成沉淀,沉淀对电子束的散射能力较强,在电镜下呈现出黑色颗粒,对组织细胞超微结构的观察产生影响。不同染液的沉淀形态和形成的因素不同(表1),但从整体上控制染液的pH、保证环境温湿度在合理的范围内,保证染色在密闭的环境下进行,可以大大减少染液沉淀的形成。
表1 染液沉淀形态与形成因素
染液种类 | 沉淀形态 | 形成因素 |
柠檬酸铅 | 不规则块状(图7a) | CO2污染 | 配染液的水未除CO2 |
染色时CO2污染 |
染液pH降低(吸收CO2) |
染色环境潮湿 |
未冲洗干净,染液残留 |
醋酸双氧铀 | 细长针尖状(图7b) | 长时间存放,见光分解,pH<4 |
染色时染液干燥 |
未冲洗干净,染液残留 |
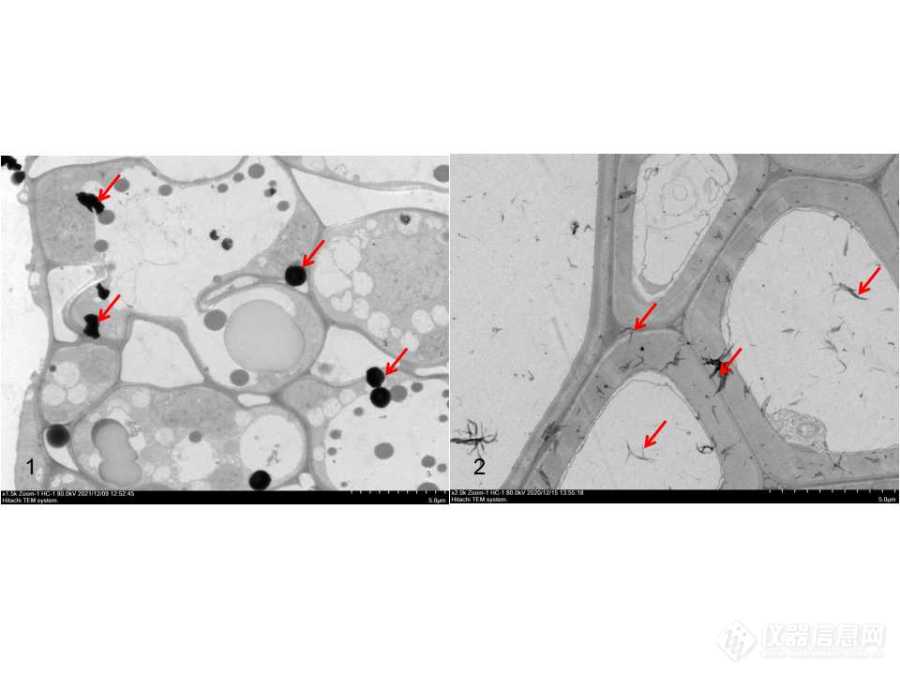
图7 染色污染(红色箭头指向部分)
1:铅污染;2::铀污染
2 结论
生物组织需经过取样、固定、清洗、脱水、渗透、包埋、切片和染色等八个主要步骤获得的超薄切片,主要应用于超微结构的观察,是形态学研究中的基础部分,可以认为是后续“进阶”实验的基石。超微结构的真实完整是实验结果可信度的来源,一张高质量的超薄切片便是来源的依据。一张超薄切片的诞生经历的过程复杂,关键点众多,需按照每一阶段规定的要求,仔细操作、认真完成,才能在透射电子显微镜下呈现真实完美的细胞超微结构。
参考文献:
[1] 周晨明,朱艳,孟丽,等.透射电镜样品取材和固定应注意的若干问题[J].医学理论与实践,2020,33(14):2416
[2] 丁明孝,梁凤霞,洪健,等.生命科学中的电子显微镜技术[M].1.北京:高等教育出版社,2021,11.
[3] 周卫东, 韦存虚, 陈义芳,等. 不同固定方法对水稻胚乳细胞超微结构的影响[J]. 扬州大学学报:农业与生命科学版, 2005, 26(3):48-51.
[4] 董渭祥, 高小彦. 植物超薄切片制备技术[J]. 植物生理学通讯, 1982(5):32-35.
[5] 黄静, 彭彬. 常规透射电镜生物样品制样条件的摸索总结[J]. 川北医学院学报, 2021,35(1):119-121.
[6] 吕广艳, 高船舟, 曲淑贤,等. 透射电镜超薄切片污染产生的原因及对策[J]. 医学信息(上旬刊), 2006, 19(12):2195-2196.
[7] 肖欣, 周正平. 生物样品透射电镜超薄切片质量问题探讨[J]. 贵州医药, 2015, 39(12):1103-1104.
[8] 金立强, 张东生. 超薄切片皱褶的形成特点和消除方法[J]. 南京医科大学学报:自然科学版, 2007, 27(2):207-208.
[9] 马莉, 张欠欠, 王逢会. 电镜超薄切片常见问题初探[J]. 现代妇女:理论前沿, 2014(12):224.
[10] 黄远洁, 莫肖敏, 孟春梅,等. 3种常规透射电子显微镜超薄切片染色方法的对比分析[J]. 广西医科大学学报, 2015, 32(6):912-913.
[11] 何晓华, 刘斌, 郭付振. 生物样品超薄切片染色方法的改进[J]. 教育教学论坛, 2019(47):74-75.
[12] 祁荣, 郭丽. 透射电子显微镜超薄切片批量染色方法的建立[J]. 中国医药科学, 2022, 12(9):32-34.








