推荐厂家
暂无
暂无

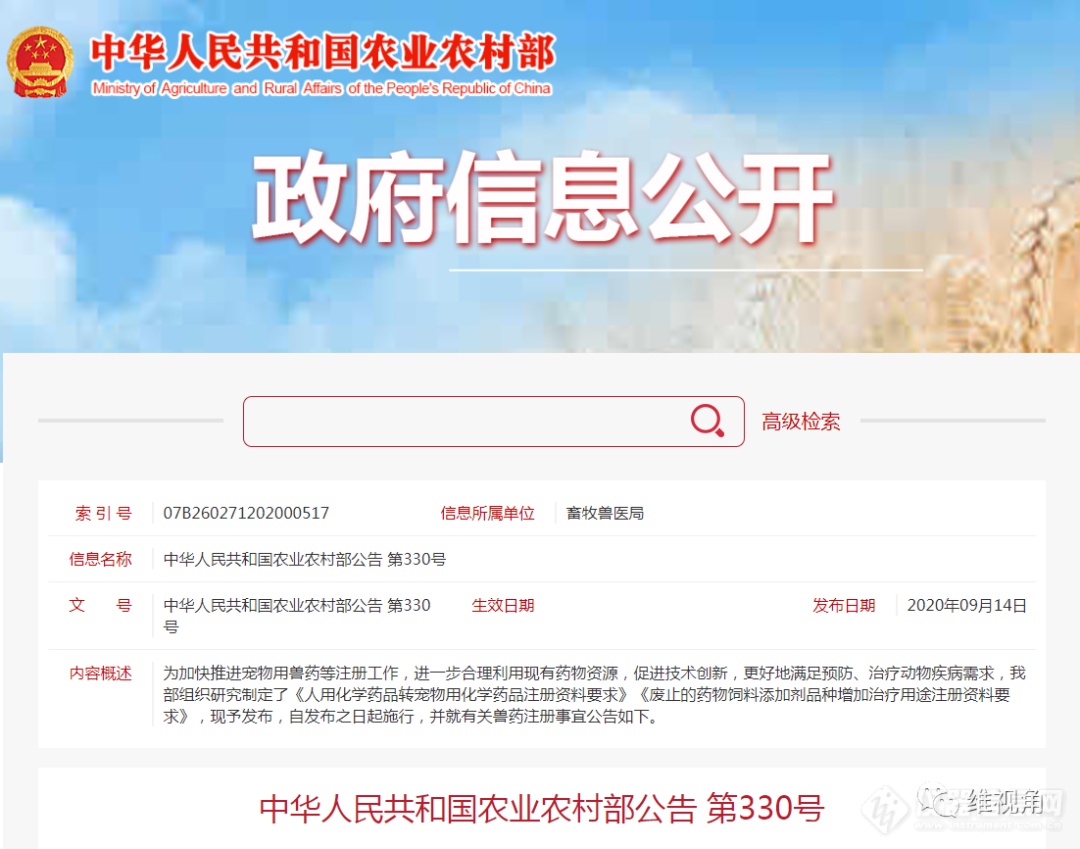




“中药和天然药物的分开注册审评,将会对药物开发方式和方向产生重大影响,也将促进中药的进一步开发和两个产业的发展,相关单位要保持关注。”在日前由《中国天然药物》和《中国药学年鉴》编委会共同主办的“中国创新药物研发战略新思路”论坛上,中国科学院上海药物研究所研究员果德安如是提醒参会研究人员和企业负责人。果德安提及的“分开注册审评”,针对的即是目前正在挂网征求意见的《天然药物注册管理补充规定》(下称“《补充规定》”)及《天然药物研究技术要求》(下称“《技术要求》”)两个文件。《医药经济报》记者了解到,这两个文件是继2008年实施的中药注册管理补充规定之后我国药品注册审评体系建设的再进一步。由此,中药和天然药物将完全步入不同的发展路径。据悉,《补充规定》和《技术要求》首先强调了天然药物是基于现代医药理论指导下使用的天然药用物质及其制剂,并且对天然药物新药、仿制药和改剂型产品的注册、质量保证和控制等方面制定了具体的要求。对接西方审评理念随着《补充规定》及《技术要求》的制定,今后中药与天然药物将彻底实现从概念到政策等层面的泾渭分明。记者了解到,2008年开始实施的《中药注册管理补充规定》,强调了中药是基于中医药研究规律下开发的药品,其使得中药新药的注册审评有了专门的标准,同时也作为中药开发和研究导向。但一直以来,中药和天然药物新药开发审评体系都基于中医药理论和临床实践基础的思路并未得到实质性改变,天然药物仍被作为中药进行相关的实验研究。而另一方面,基于对中药现代化研究的迫切需求,多年来国内机构和企业又往往过多地希望通过现代医学理论研究,来阐述中药的机制机理和指导中药的开发,这又使得部分中药产品在现代医学的基础上进行了相关的科研实验。这同时存在的两方面矛盾,使得中药和天然药物的新药开发方向难以明确,也使得中药现代化之路一直在徘徊。“其实中药现代化怎么走,首先概念要搞清楚。国家出台中药和天然药物注册管理的补充规定,其目的就是从概念上让两者分开,从而在政策上引导企业对不同类型产品进行区别研究,而不是笼统地强调中医还是西医理论。”在论坛上,河北万邦复临药业总经理冯准如是表示。阅读《补充规定》和《技术要求》可以发现,《补充规定》在设计上已经逐渐向欧美国家对植物药的要求靠近,其对天然药物的药用成分和药用机理并不要求完全清楚,但非常强调产品的有效性以及产品质量过程控制。相对于《中药注册管理补充规定》,《补充规定》明确指出,天然药物是指在现代医药理论指导下使用的天然药用物质及其制剂,并且天然药物的研制应当符合现代医药理论,注重实验研究证据,体现临床应用价值,保证天然药物的安全有效和质量稳定均一;同时还要求天然药物“应保证上市药品批与批之间质量的稳定均一可控,明确全过程质量控制的方法和条件,尽量阐明所含化学成分”。据悉,为能够尽快落实和实施《补充规定》,目前国家食品药品监督管理局已经在着手进行中药和天然药物分开审评的相关工作。
从大的方面了解一下!大家多鼓励,以便早日入住!:)[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=185959]药物国际注册管理.pdf[/url]
有哪家公司可以接仿制药注册的,我这边有个项目想找家公司帮忙做注册项目管理,从研发到注册申报整个流程的,有意向的可以联系我。我的QQ:120784551,邮箱:xijunhui_03@sohu.com项目比较急,谢谢。

 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询


