

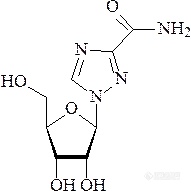
图1-1 利巴韦林的分子结构
| 利巴韦林 | 5 g |
| 葡萄糖 | 50 g |
| 注射用水 | 加至1000 ml |
| 利巴韦林 | 5 g |
| 葡萄糖 | 50 g |
| 1N盐酸 | 适量 |
| 注射用水 | 加至1000 ml |
|
| 处方3 | 处方4 | 处方5 |
| 利巴韦林 | 5 g | 5 g | 5 g |
| 枸橼酸 | 25 g | 2.5 g | 1.25 g |
| 枸橼酸钠 | 60 g | 6 g | 3 g |
| 葡萄糖 | 50 g | 50 g | 50 g |
| 注射用水 | 加至1000 ml | 加至1000 ml | 加至1000 ml |
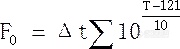 式(2-1)
式(2-1)
| 方法编号: | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 活性碳量: | 1‰ | 1‰ | 3‰ | 3‰ |
| 加热温度(℃): | 80 | 30 | 80 | 30 |
| 保温时间(min): | 30 | 30 | 30 | 30 |
|
| 100 ml : 0.1 g | 100 ml : 0.2 g | 100 ml : 0.5 g |
| 利巴韦林 | 1 g | 2 g | 5 g |
| 枸橼酸 | 2.5 g | 2.5 g | 2.5 g |
| 枸橼酸钠 | 6 g | 6 g | 6 g |
| 葡萄糖 | 50 g | 50 g | 50 g |
| 注射用水 | 加至1000 ml | 加至1000 ml | 加至1000 ml |
表3-1 利巴韦林葡萄糖注射液处方2检查结果
| 名称 | 外观性状 | pH值 |
| 母液 | 无色的澄明液体 | 5.02 |
| 灭菌后 | 无色的澄明液体 | 4.80 |
表3-2 利巴韦林葡萄糖注射液处方3、4、5检查结果
| 处方 | 外观性状 | pH值 | |||
| 母液 | 100 ℃灭菌 | 110 ℃灭菌 | 120 ℃灭菌 | ||
| 处方3 | 无色的澄明液体 | 5.02 | 4.99 | 5.03 | 4.83 |
| 处方4 | 无色的澄明液体 | 5.00 | 5.01 | 4.98 | 4.81 |
| 处方5 | 无色的澄明液体 | 5.05 | 4.99 | 4.82 | 4.70 |
表3-3 利巴韦林葡萄糖注射液处方4检查结果(见实验记录I-p9, p10, p12)
| 检查指标 | 母液 | 110℃灭菌30min | 121℃灭菌8min |
| 5-羟甲基糠醛 | 0.013 | 0.013 | 0.014 |
| 有关物质(%) | 0.04 | 0.04 | 0.05 |
| 主峰面积 | 22209.77 | 22212.69 | 22103.16 |
| 相对含量(%) | — | 100.0 | 99.5 |
| 葡萄糖含量(%) | 100.5 | 100.3 | 100.9 |
表3-4 活性炭吸附试验检查结果
| 名称 | 外观性状 | pH值 | 5-羟甲基糠醛 | 有关物质(%) | 主峰面积 | 相对含量(%) | 葡萄糖含量(%) |
| 母液 | 无色澄明液体 | 5.03 | 0.012 | 0.04 | 22798.88 | — | 100.7 |
| Ⅰ | 无色澄明液体 | 4.98 | 0.014 | 0.04 | 21861.26 | 95.9 | 100.6 |
| Ⅱ | 无色澄明液体 | 5.01 | 0.013 | 0.05 | 21912.75 | 96.1 | 100.3 |
| Ⅲ | 无色澄明液体 | 5.04 | 0.012 | 0.04 | 22028.67 | 96.6 | 100.1 |
| Ⅳ | 无色澄明液体 | 4.99 | 0.015 | 0.04 | 21924.32 | 96.2 | 100.9 |
表3-5 利巴韦林葡萄糖注射液处方6检查结果
| 规格 | 名称 | 外观性状 | pH值 | 5-羟甲基糠醛 | 有关物质(%) | 主峰面积 | 相对含量(%) | 葡萄糖含量(%) |
| 100ml:0.1g | 灭菌前 | 无色澄明液体 | 5.07 | 0.013 | 0.04 | 22218.70 | — | 100.3 |
| 灭菌后 | 无色澄明液体 | 5.03 | 0.015 | 0.05 | 22215.33 | 100.0 | 100.5 | |
| 100ml:0.2g | 灭菌前 | 无色澄明液体 | 5.08 | 0.015 | 0.05 | 22459.10 | — | 100.2 |
| 灭菌后 | 无色澄明液体 | 5.10 | 0.014 | 0.04 | 22469.11 | 100.0 | 100.4 | |
| 100ml:0.5g | 灭菌前 | 无色澄明液体 | 5.11 | 0.012 | 0.04 | 22423.48 | — | 100.8 |
| 灭菌后 | 无色澄明液体 | 5.09 | 0.016 | 0.04 | 22435.91 | 100.0 | 101.1 |
表3-6 利巴韦林葡萄糖注射液溶液稳定性试验结果(见实验记录I-p21)
| 规格 | 时间(h) | 0 | 1 | 2 | 4 | 8 |
| 100ml:0.1g | 有关物质(%) | 0.03 | 0.04 | 0.04 | 0.04 | 0.04 |
| 主峰面积 | 22294.56 | 22239.88 | 22490.16 | 22510.81 | 22585.88 | |
| 相对含量(%) | — | 99.8 | 100.9 | 101.0 | 101.3 | |
| 100ml:0.2g | 有关物质(%) | 0.04 | 0.05 | 0.04 | 0.05 | 0.05 |
| 主峰面积 | 22512.53 | 22591.38 | 22447.16 | 22874.97 | 22657.77 | |
| 相对含量(%) | — | 100.4 | 99.7 | 101.6 | 100.6 | |
| 100ml:0.5g | 有关物质(%) | 0.04 | 0.04 | 0.04 | 0.06 | 0.04 |
| 主峰面积 | 22562.77 | 22467.40 | 22571.61 | 22895.33 | 22660.84 | |
| 相对含量(%) | — | 99.6 | 100.0 | 101.5 | 100.4 |
表3-7 利巴韦林葡萄糖注射液(100 ml : 0.1 g)小试样品影响因素试验检查结果
| 时间(天) | 外观性状 | pH值 | 5-羟甲基糠醛 | 有关物质(%) | 主峰面积 | 相对含量(%) | 葡萄糖含量(%) | |
| 0 | 无色澄明液体 | 5.03 | 0.015 | 0.05 | 22215.33 | — | 100.5 | |
| 4500 lx | 5 | 无色澄明液体 | 5.05 | 0.016 | 0.04 | 22273.80 | 100.3 | 100.6 |
| 10 | 无色澄明液体 | 5.11 | 0.022 | 0.04 | 22353.68 | 100.6 | 100.5 | |
| 4℃ | 5 | 无色澄明液体 | 5.10 | 0.014 | 0.04 | 22234.08 | 100.1 | 100.3 |
| 10 | 无色澄明液体 | 5.05 | 0.013 | 0.05 | 22359.00 | 100.6 | 100.2 | |
| 60℃ | 5 | 无色澄明液体 | 5.08 | 0.062 | 0.04 | 22225.21 | 100.0 | 100.4 |
| 10 | 无色澄明液体 | 5.07 | 0.192 | 0.04 | 22294.79 | 100.4 | 100.8 | |
表3-8 利巴韦林葡萄糖注射液(100 ml : 0.2 g)小试样品影响因素试验检查结果
| 时间(天) | 外观性状 | pH值 | 5-羟甲基糠醛 | 有关物质(%) | 主峰面积 | 相对含量(%) | 葡萄糖含量(%) | |
| 0 | 无色澄明液体 | 5.10 | 0.014 | 0.04 | 22469.11 | — | 100.4 | |
| 4500Lx | 5 | 无色澄明液体 | 5.09 | 0.015 | 0.05 | 22463.29 | 100.0 | 100.4 |
| 10 | 无色澄明液体 | 5.08 | 0.021 | 0.04 | 22635.92 | 100.7 | 100.6 | |
| 4℃ | 5 | 无色澄明液体 | 5.06 | 0.016 | 0.04 | 22486.93 | 100.1 | 100.2 |
| 10 | 无色澄明液体 | 5.04 | 0.014 | 0.05 | 22574.75 | 100.5 | 100.3 | |
| 60℃ | 5 | 无色澄明液体 | 5.07 | 0.067 | 0.05 | 22550.79 | 100.4 | 100.5 |
| 10 | 无色澄明液体 | 5.06 | 0.186 | 0.04 | 22637.07 | 100.8 | 100.7 | |
表3-9 利巴韦林葡萄糖注射液(100ml : 0.5 g)小试样品影响因素试验检查结果
| 时间(天) | 外观性状 | pH值 | 5-羟甲基糠醛 | 有关物质(%) | 主峰面积 | 相对含量(%) | 葡萄糖含量(%) | |
| 0 | 无色澄明液体 | 5.09 | 0.016 | 0.04 | 22435.91 | — | 101.1 | |
| 4500Lx | 5 | 无色澄明液体 | 5.11 | 0.015 | 0.05 | 22222.25 | 99.0 | 100.9 |
| 10 | 无色澄明液体 | 5.09 | 0.024 | 0.06 | 22555.09 | 100.5 | 100.8 | |
| 4℃ | 5 | 无色澄明液体 | 5.06 | 0.017 | 0.04 | 22529.90 | 100.4 | 100.7 |
| 10 | 无色澄明液体 | 5.09 | 0.015 | 0.05 | 22498.47 | 100.3 | 100.5 | |
| 60℃ | 5 | 无色澄明液体 | 5.05 | 0.069 | 0.05 | 22537.43 | 100.5 | 101.2 |
| 10 | 无色澄明液体 | 5.12 | 0.204 | 0.04 | 22491.45 | 100.2 | 101.3 | |
4结论
|
| 100 ml : 0.1 g | 100 ml : 0.2 g | 100 ml : 0.5 g |
| 利巴韦林 | 100 g | 200 g | 500 g |
| 枸橼酸 | 250 g | 250 g | 250 g |
| 枸橼酸钠 | 600 g | 600 g | 600 g |
| 葡萄糖 | 5000 g | 5000 g | 5000 g |
| 注射用水 | 加至100 L | 加至100 L | 加至100 L |