摘要:建立应用固相萃取(SPE)-高效液相色谱(HPLC)-荧光检测法测定食用菌中多菌灵(MBC)的分析方法。食用菌经乙酸乙酯提取,C18色谱柱分离后,采用带有荧光检测器的HPLC法检测,外标法定量。对样品前处理和色谱分离条件进行研究和优化。通过比较匀浆、超声、索氏提取和快速溶剂萃取四种提取方式,SCX和MCX固相萃取柱净化的对比,确定食用菌中多菌灵的检测条件:超声提取30min,MCX固相萃取柱净化。食用菌中多菌灵的加标回收率在95.5%~98.5%之间,相对标准偏差小于3%,多菌灵的残留检出限量为0.05mg.kg-1该分析方法的准确性和灵敏度均达到农药残留分析的要求。
关键词:高效液相色谱;荧光检测器;食用菌;多菌灵
多菌灵是一种苯并咪唑类杀菌剂,学名2-苯并咪唑基氨基甲酸甲酯,简称MBC。是一种高效、低毒和广谱的内吸性杀菌剂,同时具有预防和治疗作用,广泛应用于蔬菜、水果等多种病害的防治。近些年来,大量的国内外研究资料表明,食用菌是真菌,而食用菌的病害也多是由致病的真菌引起的,使用杀菌剂易使食用菌产生伤害。而且因食用菌栽培周期短,尤其在出菇期使用多菌灵等杀菌剂,药剂极易残留在子实体内,对人类健康不利。现在美国等一些发达国家已明令禁止在食用菌生产中使用多菌灵等杀菌剂,因此对多菌灵在食用菌中以及培养料中的残留动态研究非常重要[2]。笔者通过多种方法的比较,拟提出一种适用于食用菌样品中多菌灵残留快速检测方法。
1 .实验部分
1.1 仪器与试剂
1.1.1仪器设备:LC-20AT高效液相色谱仪配备四元低压洗脱装置和荧光检测器(日本Shimadzu公司)、C18色谱柱、固相萃取柱、超声波清洗器、快速溶剂萃取装置、食品料理机、离心机、漩涡混合器、旋转蒸发仪、氮吹浓缩仪及常规玻璃器皿。
1.1.2 试剂:多菌灵标样(农业部环境保护科研监测所)为100ug/ml溶于甲醇;乙腈、乙酸乙酯、甲醇为色谱纯;氨水;磷酸二氢铵;磷酸氢二钠;盐酸;氯化钠;无水碳酸钠均为分析纯。水为电阻18.20 MΩ的超纯水。
1.2 方法
1.2.1样品处理:将干食用菌置于食品料理机中打碎,用样品袋密封保存。
1.2.2提取:准确称取试样1.0000g(精确至0.0001g)于50mL离心管中,加入0.1mol/L碳酸钠溶液10mL,放置30分钟。加入乙酸乙酯20mL,在漩涡混合器上提取1分钟,然后放入超声波清洗器中超声提取30分钟,加入约2克氯化钠,以5000r/min的转速离心3分钟,将上清液转移至150mL浓缩瓶中,再在离心管中加入20mL乙酸乙酯,重复提取一次,合并上清液。于40℃水浴中旋转蒸发至近干。加入0.1mol/L盐酸5.0mL溶解残渣,待净化。
1.2.3净化:固相萃取柱(天津市天兴达MCX:150mg/6mL)依次用6mL甲醇预处理、6mL水平衡,待液面到达填料表面时迅速加入1.2.1得到的提取液,依次用6mL水、6mL甲醇淋洗固相萃取柱,最后用5%氨水-甲醇溶液洗脱,收集洗脱液5.0mL于10mL离心管中,45℃氮吹仪吹干后,用1.0mL流动相溶解,以 0.2um滤膜过滤至样品瓶中,待测定。
1.2.4 标准溶液配置
1.2.4.1 标准储备液:取1支多菌灵标准品,全部转移至10mL容量瓶中,用甲醇定容至刻度,相当于浓度为10.00ug/mL多菌灵标液,零下18℃保存,有效期为1个月。
1.2.4.2标准工作溶液:取5只10mL容量瓶,分别加入10.00ug/mL多菌灵标准储备液0.05、0.10、0.25、0.50、1.00mL,以甲醇定容至刻度,相当于多菌灵浓度分别为0.05、0.10、0.25、0.50、1.00ug/mL。
1.2.5色谱条件:色谱柱SHIMADZU VP-ODS 5um(4.6mm×150mm);流动相V(0.02mol/L,pH值6.8磷酸盐缓冲液)+V(乙腈)=80+20,流动相用前经0.45um滤膜过滤,并超声脱气15min;流速为1.0mL/min;柱温:40℃;激发波长286nm,发射波长315nm;进样量:20ul。
2 结果与分析
2.1 提取方法确定:分别用乙腈匀浆提取,索氏提取,超声波辅助提取,快速溶剂萃取四种提取方法对质量控制样品中的多菌灵进行提取效率比较,结果见表1
2.2 固相萃取柱净化方法的选择:通过考察淋洗曲线,最终确定SPE的淋洗体积为5%氨水-甲醇溶液5.0ml;分别用天兴达MCX(150mg/6mL)、SUPELCO SCX(500mg/3mL)、德国CNW MCX(150mg/6mL)小柱对提取液的净化效果进行了考查,结果为天兴达MCX(150mg/6mL)的回收率最高(见表2)。
2.3 流动相选择:分别考查了甲醇+水、甲
醇+磷酸盐缓冲溶液、乙腈+水、乙腈+磷酸盐缓冲溶液作为流动相对多菌灵的分离效果,结果表明乙腈+磷酸盐缓冲溶液分离效果最好,多菌灵高效液相色谱图见图1.
表1 样品中多菌灵回收率及相对标准偏差Table 1 Carbendazim recoveries in the sample and the relative standarddeviation
提取方法 | 标称值mg/kg | 测得值mg/kg | 回收率% | 相对标准偏差(RSD) |
匀浆提取 | 0.2 | 0.179 | 89.5 | 2.23 |
索氏提取 | 0.2 | 0.175 | 87.5 | 2.41 |
超声提取 | 0.2 | 0.194 | 97 | 1.98 |
快速溶剂萃取 | 0.2 | 0.189 | 94.5 | 1.96 |
表2 不同填料和厂家固相萃取小柱对多菌灵回收率比较
Table 2 Fillers and manufacturers of different solid-phase extraction column recovery compared to carbendazim
萃取小柱 | 加标量mg/kg | 回收量mg/kg | 回收率% | 相对标准偏差(RSD) |
天兴达MCX | 0.2 | 0.197 | 98.5 | 1.62 |
SUPELCO SCX | 0.2 | 0.191 | 95.4 | 1.85 |
德国CNW MCX | 0.2 | 0.195 | 97.3 | 1.95 |
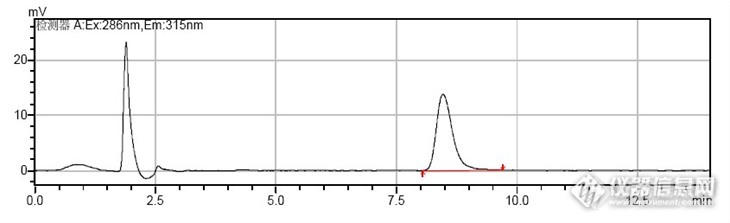 图1 多菌灵高效液相色谱分析图
图1 多菌灵高效液相色谱分析图
Figure 1 High performance liquid chromatography analysis chart of carbendazim
2.4 线性范围和回收率
2.4.1 线性范围:以峰面积为纵坐标,以标准样品浓度为横坐标绘制标准曲线。多菌灵标准品的回归方程为Y=66350200X-0.00656181 R=0.9999。从图3可以看出,多菌灵在0.05~1ug/mL范围内有很好的线性关系。

图2 多菌灵标准曲线
Figure 2 Calibration curve of carbendazim
2.4.2 回收率和方法检出限:取已搅碎的食用菌样品,分别做0.05、0.20、1.00mg/kg三个浓度水平3次平行的添加回收率试验。样品按前述方法处理和测定,从表3中可以看出食用菌样品中多菌灵平均回收率为95.5%~98.5%,相对标准偏差(RSD)≤2.23%此方法的仪器检出限为0.05ug/mL,方法检出限=仪器检出限×定容体积×稀释倍数/称样量=0.05×1×1/1=0.05mg/kg。
表3 样品中多菌灵加标回收率及相对标准偏差
Table 3 Carbendazim recoveries in the sample and the relative standard deviation
加标量mg/kg | 平均回收量mg/kg | 平均回收率% | 相对标准偏差(RSD) |
0.05 | 0.048 | 96.3 | 2.23 |
0.2 | 0.197 | 98.5 | 2.73 |
1 | 0.955 | 95.5 | 2.56 |
3 结论
在对食用菌中多菌灵残留量的测定中,使用超声提取可以提高回收率,使用荧光检测器可以排除食用菌中大部分干扰物质的影响,能够达到较高的灵敏度,同时能够避免出现假阳性结果,保证了外标法定量的准确性和重现性。用高效液相色谱SHIMADZU VP-ODS 5um(4.6mm×150mm),流动相(V磷酸盐+V乙腈=80+20),流速为1.0mL/min,激发波长为286nm,发射波长为315nm进行分析,建立了食用菌中多菌灵残留量的分析方法(保留时间为8.363min,回收率为95.5%~98.5%)。国家食品安全标准规定食用菌中多菌灵残留的最高限量为0.5mg/kg,该方法的检出限为0.05mg/kg,符合农药残留分析的要求;与其他方法相比,该方法具有简单、快速、准确的特点,可满足食用菌中多菌灵残留检测的需要,可以作为常规残留检测方法使用。
参考文献
[1] 刘杰,杨春亮,查玉兵等.凝胶渗透色谱净化-高效液相色谱法同时检测葡萄中多菌灵和噻菌灵残留[J],安徽农业科学,2010,38(23)
[2] 牛玉宏,汤锋.平菇中多菌灵·甲基硫菌灵残留分析方法研究[J],安徽农业科学,2009,37(30)
[3] 刘杰,杨春亮,查玉兵等.高效液相色谱法-荧光检测器同时检测龙眼中多菌灵和噻菌灵残留[J],广东农业科学,2010,(3):150-153.
[4] 欧翔,黄义彬,李卿.蔬菜中多菌灵残留量的高效液相色谱法测定方法[J],农技服务,2010,27(4):470-471.
[5] GB/T 23380-2009 水果、蔬菜中多菌灵残留的测定高效液相色谱法
[6]NY/T 1680-2009 蔬菜水果中多菌灵等4种苯并咪唑类农药残留量的测定高效液相色谱法


 图1 多菌灵高效液相色谱分析图
图1 多菌灵高效液相色谱分析图